Всё, что необходимо знать про железо и медь

Медь
Для человека медь является очень важным веществом. В организме она концентрируется в мышцах и костях, в мозге, крови, печени и почках. Поэтому, при ее нехватке возможен сбой работы всех жизненно важных органов.
Медь принимает участие в построении необходимых белков и ферментов, в процессах роста клеток и тканей.
Она необходима для процесса кроветворения, без меди организму практически невозможно превращать железо в гемоглобин.
Кроме того, медь снабжает клетки веществами, которые необходимы для нормального обмена: она транспортирует железо из печени, при ее нехватке переносить железо будет некому, оно будет накапливаться, а это может привести к серьёзными последствиями.
Медь делает крепкими и здоровыми наши кости. Людям, которые страдают хрупкостью костей, бывает достаточно начать употреблять добавки с медью, чтобы прекратить переломы. Благодаря меди кровеносные сосуды долго остаются прочными и эластичными, так как она способствует образованию эластина.
Вместе с витамином С медь поддерживает иммунную систему, помогает ей защищать организм от инфекций. Упругость и эластичность кожи обеспечивается присутствием коллагена, в составе которого тоже есть медь.
Этот микроэлемент стимулирует активность гормонов гипофиза, поддерживая работу эндокринной системы. Медь нормализует процесс пищеварения, защищая пищеварительную систему от различных повреждений и воспалений.
Обычно организму достаточно меди, попадающей с продуктами питания, а нехватка меди чаще обусловлена природными особенностями человека или нарушением обменных процессов.
Много меди содержат орехи, сырой яичный желток, печень, бобовые, злаки, кисломолочные продукты, овощи, фрукты и ягоды.
Медь присутствует в свежем мясе, рыбе, морепродуктах, сое, ржаном хлебе, спарже и картофеле.
Достаточно много этого микроэлемента в укропе, лапчатке прямостоячей, сушенице, марене красильной, листьях чайного куста, лобелии. Питьевая вода также содержит медь — около 1 мг на литр.
Людям с темными волосами нужно больше меди, чем светловолосым, так как она необходима для поддержания цвета волос. Нехватка ее проявляется ранней сединой.
Железо
Среди необходимых микроэлементов железо является одним из самых важных. Без него не может происходить образование миоглобина и гемоглобина. Многие ферменты образуются с участием железа, оно регулирует работу иммунной системы. Практически все биохимические процессы в наших клетках протекают с участием железа.
Этот незаменимый микроэлемент помогает работе щитовидной железы, поддерживает высокий уровень иммунной защиты. Железо способствует выведению токсинов, участвует в процессах регенерации, оно улучшает состояние кожи, волос и ногтей.
С его помощью контролируется синтез ДНК и холестериновый обмен, протекают окислительно-восстановительные реакции, замедляется образование свободных радикалов.
Обычное сбалансированное питание полностью обеспечивает человека необходимым количеством железа, но его нехватку все-таки испытывают многие люди, так как усвоение железа происходит по-разному.
Железо, которое содержится в красном мясе, называется «органическим», оно усваивается лучше, чем «неорганическое» железо из растений. Всасывание железа в кишечнике замедляется в присутствии щавелевой и фитиновой кислот. Наоборот, лучшему усвоению железа помогают витамины группы В и С.
Основные источники железа — говяжья и телячья печень, рыба, яйца, моллюски, патока, сушеные грибы, какао, гречневая крупа, зерна ржи и пшеницы. Довольно много железа в луке, сельдерее, петрушке, в ботве репы, моркови, в салате, щавеле, крапиве, цветной и белокочанной капусте, фасоли, горохе, чечевице, огурцах и помидорах, хрене и чесноке.
Меньшее количество этого элемента содержат земляника, клубника, абрикосы, яблоки, персики, груши, черника, вишня, малина, смородина, сливы, свекла, тыква, картофель.
Дефицит железа может привести к анемии, сильной утомляемости, понижению способности к обучению, чувствительности к холоду, к потере работоспособности и выносливости, нарушению работы щитовидной железы, мышечной слабости, деформации ногтей, потере вкуса и нервным расстройствам.
Источник: http://www.justlady.ru/articles-133457-vsyo-chto-neobhodimo-znat-pro-zhelezo-i-med
Медь — свойства, характеристики свойства

Медь — это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Латинское название Cuprum произошло от имени острова Кипр. Известны факты, что на Кипре ещё в III веке до нашей эры находились медные рудники и местные умельцы выплавляли медь. Купить медь можно в комании «КуПрум».
По данным историков, знакомству общества с медью около девяти тысячелетий. Самые древние медные изделия найдены во время археологических раскопок на местности современной Турции.
Археологи обнаружили маленькие медные бусинки и пластинки для украшения одежды. Находки датируются рубежом VIII-VII тыс. до нашей эры.
Из меди в древности изготавливали украшения, дорогую посуду и различные инструменты с тонким лезвием.
Великим достижением древних металлургов можно назвать получение сплава с медной основой — бронзы.
Основные свойства меди
1. Физические свойства
На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-голубого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.
2. Химические свойства
Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь.
С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) — верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы.
В зависимости от условий, соединения меди проявляют кислотные или основные свойства.
Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды — это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование.
Обогащают медные руды методом флотации и окислительного обжига.
Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность.
Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди — это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.
Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении.
Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом.
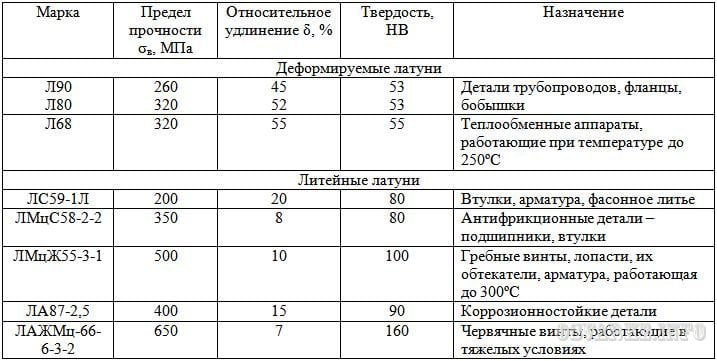
Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания.
К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди.
Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Источник: http://cu-prum.ru/med.html
Железо сталь и прочие металлы

Железо и сталь — важнейшие металлы. Сталь получают из железа. Из нее делают множество предметов — от нефтяных вышек до канцелярских скрепок.
Наряду с 80 чистыми металлами людям известно немало сплавов — смесей металлов, качества которых отличаются от качеств чистых металлов. Башенные краны, мосты, другие сооружения делают из стали, содержащей до 0,2% углерода.
Углерод делает сталь прочнее, причем она сохраняет ковкость. Сталь покрывают краской для защиты от коррозии.
Железо и сталь
Железо — это элемент. Его добывают из руды — соединения железа с кислородом. Большая часть добытого железа идет на производство стали, сплава железа с углеродом.Наиболее распространенные железные руды: магнетит(вверху) и гематит(внизу). Железо добывается из руды в доменных печах. Этот процесс называется плавкой.
В печи через слой железной руды, известняка и кокса продувают очень горячий воздух. Кокс представляет собой почти чистый углерод, его получают нагреванием угля.
Углерод кокса соединяется с кислородом, образуя моноксид углерода, который затем «вытягивает» кислород из руды, оставляя чистое железо, и образует диоксид углерода. Это пример реакций восстановления. Руда, кокс и известняк поступают в печь. Известняк реагирует с имеющимися в руде примесями, образуя шлак.
Внутри печи раскаленный воздух реагирует с углеродом. Образуется моноксид углерода. При этом температура в печи повышается до 2000°С. Затем оксид углерода реагирует с кислородом руды, восстанавливая ее до железа. Расплавленный шлак вытекает из нижней части печи. Его используют в строительстве дорог.
В конце расплавленное железо выводится наружу. Доменная печь непрерывно функционирует 10 лет, пока её стенки не начнут разрушаться. Высота доменной печи 30 метров, толщина её стен 3 метра.
Железо, получаемое из руды, содержит углерод (около 4%) и другие примеси, в частности серу. Примеси делают железо хрупким, поэтому большую его часть перерабатывают в сталь. При этом из железа удаляются примеси. В стальных скрепках около 0,08% углерода.
Инструменты делают из стали, содержащей хром, ванадий и до 1% углерода. Сталь получают при воздействии на расплавленное железо кислорода. Часто в железо добавляют небольшое количество стального лома. Кислород реагирует с углеродом, содержащимся в железе, при этом образуется моноксид углерода, используемый как топливо.
После очистки в стали остается не более 0.04% углерода; его количество зависит от марки стали. Сталь получают также путем переплавки стального лома в дуговой электропечи. Для получения стали расплавленное железо и стальной лом заливают в печь, называемую конвертером.
В конвертер под высоким давлением закачивается почти чистый кислород. При его реакции с углеродом получается моноксид углерода (см. так же статью «Химические реакции«). Другой способ получения стали — переплавка стального лома в дуговой электропечи. Мощный электрический ток (см.
статью «Электричество«) расплавляет лом. Расплавленный шлак вытекает из нижней части печи. Его используют в строительстве дорог.
Сплавы
Сплавом называется смесь двух или более металлов или металла и иного вещества.Так, латунь — это сплав меди и цинка. Латунь прочнее меди, ее легко обрабатывать, и она не подвержена коррозии. В чистых металлах атомы «упакованы» в тесные ряды (рис.
слева). Ряды могут скользить относительно друг друга, что делает металл мягким.При резких сдвигах рядов металл ломается. В сплаве другие атомы укрепляют металл (см. рис. справа), т.к. сдвиг рядов уже невозможен. Поэтому сплавы прочнее чистых металлов.
Многие металлы сами по себе чересчур мягкие, чтобы их можно было использовать, зато их сплавы могут выдерживать большое давление и высокие температуры (см. статью «Тепло и температура«). Сталь — это сплав железа и углерода, неметалла.
Добавляя небольшие количества других металлов, можно получить разновидности стали. Ножи и вилки делают из нержавеющей стали — сплава стали, хрома и никеля. Сплавы стали с марганцем чрезвычайно прочны и используются в промышленности для изготовления режущих инструментов.
Алюминиево-магниевые сплавы легки, прочны и не подвержены коррозии. Из них делают велосипеды и самолеты (см. статью «Полет«).
Важнейшие металлы и сплавы
Алюминий. Очень легкий серебристо-белый металл, не подверженный коррозии. Его получают из бокситов путем электролиза. Из алюминия делают электропровода, самолеты, корабли (см. статью «Плавучесть«), автомобили, банки для напитков, фольгу для приготовления пищи. Алюминиевые банки для напитков очень легкие и прочные.
Латунь. Ковкий сплав меди и цинка. Из латуни делают украшения, орнаменты, музыкальные инструменты, винты, кнопки для одежды.
Бронза. Известный с древнейших времен ковкий, не подверженный коррозии сплав меди и олова.
Кальций. Мягкий серебристо-белый металл. Входит в состав известняка и мела, а также костей и зубов животных. Кальций в человеческом организме содержится в костях и зубах. Он используется в производстве цемента и высоко качественной стали.
Хром. Твердый серый металл. Используется в производстве нержавеющей стали. Хромом покрывают металлические изделия в защитных целях и для придания им зеркального блеска.
Медь. Ковкий красноватый металл. Из меди делают электропровода, резервуары для горячей воды. Медь входит в состав латуни, бронзы, мельхиора.
Мельхиор. Сплав меди и никеля. Из него делают почти все «серебряные» монеты.
Золото. Мягкий неактивный ярко-желтый металл. Используется в электронике и в ювелирном деле.
Железо. Ковкий серебристо-белый ферромагнетик. Добывается в основном из руды в доменных печах. Используется в инженерных конструкциях, а также в производстве стали и сплавов. В нашей крови тоже есть железо.
Свинец. Тяжелый ковкий ядовитый синевато-белый металл. Добывается из минерала галенита. Из свинца делают электрические батареи, крыши и экраны, защищающие от рентгеновских лучей.
Магний. Легкий серебристо-белый металл. Горит ярко-белым пламенем. Используется для сигнальных огней и фейерверков. Входит в состав легких сплавов. В праздничных ракетах есть магнии и другие металлы.
Ртуть. Тяжелый серебристо-белый ядовитый жидкий металл. Используется в термометрах, входит в состав зубной амальгамы и взрывчатых веществ.
Платина. Ковкий серебристо-белый неактивный металл. Используется в качестве катализатора, а также в электронике и в производстве ювелирных изделий. Платина не вступает в реакции. Из нее делают украшения.
Плутоний. Радиоактивный металл. Образуется в ядерных реакторах при бомбардировке урана и используется в производстве ядерного оружия (см. статью «Ядерная энергия и радиоактивность«).
Калий. Легкий серебристый металл. Очень химически активен. Калиевые соединения входят в состав удобрений.
Серебро. Ковкий серовато-белый металл. Хорошо проводит тепло и электричество. Из него делают украшения и столовые приборы. Входит в состав фотоэмульсии (см. статью «Фотография и фотоаппараты«).
Припой. Сплав олова и свинца. Плавится при сравнительно низкой температуре. Используется для спайки проводов в электронике.
Натрий. Мягкий серебристо-белый химически активный металл. Входит в состав поваренной соли. Используется в производстве натриевых ламп и в химической промышленности.
Сталь. Сплав железа с углеродом. Широко применяется в промышленности. Нержавеющая сталь — сплав стали с хромом — не подвержена коррозии и используется в авиакосмической индустрии (см. статью «Ракеты и космические аппараты«).
Олово. Мягкий ковкий серебристо-белый металл. Слоем олова сталь защищают от коррозии. Входит в состав таких сплавов, как бронза и припой.
Титан. Прочный белый ковкий металл, не подверженный коррозии. Из титановых сплавов делают космические аппараты, самолеты, велосипеды.
Вольфрам. Твердый серовато-белый металл. Из него изготавливают нити ламп накаливания и детали электронных приборов. Из стали с Нить вольфрамом делают накаливания режущие инструменты.
Уран. Серебристо-белый радиоактивный металл, источник ядерной энергии. Применяется при создании ядерного оружия.
Ванадий. Твердый ядовитый белый металл. Придает прочность стальным сплавам. Используется как катализатор при производстве серной кислоты.
Цинк. Синевато-белый металл. Добывается из цинковой обманки. Используется для гальванизации железа, производства электробатареек. Входит в состав латуни.
Переработка металлов
Переработка — это повторное использование сырья, способ сохранить природные ресурсы. Металлы легко поддаются переработке, т.к. их можно переплавить и получить металл такого же качества, как и тот, что получается непосредственно из руды. Переплавлять сталь и алюминий несложно и выгодно.
Медь, олово, свинец также подвергаются переплавке. Железные и стальные предметы можно извлечь из кучи отходов при помощи сильного магнита. Большую часть стали для переработки добывают из старых автомобилей и станков, но часть ее получают из фабричных металлических опилок и даже бытовых отходов.
Стальной лом смешивают с расплавленным железом и получают новую сталь.
Алюминий — не ферромагнетик, но алюминиевые отходы можно отделить от железного лома при помощи электромагнита. Больше половины банок для напитков делают из алюминия, полученного путем переработки. Чтобы узнать, сделана банка из стали или алюминия, возьми магнит.
К стальной банке он прилипнет, а к алюминиевой — нет. Переработка металлолома требует значительно меньше энергии, чем получение металла из руды, и отходов при переработке меньше. Теоретически металл можно перерабатывать сколько угодно раз.
Для переработки алюминиевых банок необходимо в 20 раз меньше энергии, чем для производства нового алюминия.
Источник: http://www.polnaja-jenciklopedija.ru/nauka-i-tehnika/zhelezo-stal-i-prochie-metalli.html
Физические и химические свойства меди
Свойства меди, которая в природе встречается и в виде достаточно крупных самородков, люди изучили еще в древние времена, когда из этого металла и его сплавов делали посуду, оружие, украшения, различные изделия бытового назначения.
Активное использование данного металла на протяжении многих лет обусловлено не только его особыми свойствами, но и простотой обработки.
Медь, которая присутствует в руде в виде карбонатов и окислов, достаточно легко восстанавливается, что и научились делать наши древние предки.
Медный слиток
Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь.
Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла. Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.
э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет.
Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском. В такой руде меди может содержаться до 80%.
- Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).
Халькопирит
Физические свойства
Медь в чистом виде представляет собой металл, цвет которого может варьироваться от розового до красного оттенка.
Радиус ионов меди, имеющих положительный заряд, может принимать следующие значения:
- если координационный показатель соответствует 6-ти — до 0,091 нм;
- если данный показатель соответствует 2 — до 0,06 нм.
Радиус атома меди составляет 0,128 нм, также он характеризуется сродством к электрону, равном 1,8 эВ. При ионизации атома данная величина может принимать значение от 7,726 до 82,7 эВ.
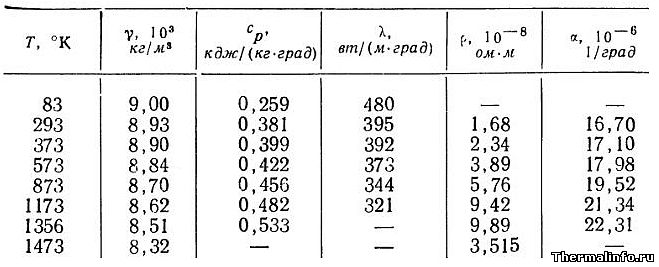
Медь — это переходный металл, показатель электроотрицательности которого составляет 1,9 единиц по шкале Полинга. Кроме этого, его степень окисления может принимать различные значения. При температурах, находящихся в интервале 20–100 градусов, его теплопроводность составляет 394 Вт/м*К. Электропроводность меди, которую превосходит лишь серебро, находится в интервале 55,5–58 МСм/м.
Так как медь в потенциальном ряду стоит правее водорода, она не может вытеснять этот элемент из воды и различных кислот. Ее кристаллическая решетка имеет кубический гранецентрированный тип, величина ее составляет 0,36150 нм. Плавится медь при температуре 1083 градусов, а температура ее кипения — 26570. Физические свойства меди определяет и ее плотность, которая составляет 8,92 г/см3.
Самородная медь
Из ее механических свойств и физических показателей стоит также отметить следующие:
- термическое линейное расширение — 0,00000017 единиц;
- предел прочности, которому медные изделия соответствуют при растяжении, составляет 22 кгс/мм2;
- твердость меди по шкале Бринелля соответствует значению 35 кгс/мм2;
- удельный вес 8,94 г/см3;
- модуль упругости составляет 132000 Мн/м2;
- значение относительного удлинения равно 60%.
Совершенно уникальными можно считать магнитные свойства данного металла, который является полностью диамагнитным.
Именно эти свойства, наряду с физическими параметрами: удельным весом, удельной проводимостью и другими, в полной мере объясняют широкую востребованность данного металла при производстве изделий электротехнического назначения.
Похожими свойствами обладает алюминий, который также успешно используется при производстве различной электротехнической продукции: проводов, кабелей и др.
Основную часть характеристик, которыми обладает медь, практически невозможно изменить, за исключением предела прочности. Данное свойство можно улучшить практически в два раза (до 420–450 МН/м2), если осуществить такую технологическую операцию, как наклеп.
Химические свойства
Химические свойства меди определяются тем, какое положение она занимает в таблице Менделеева, где она имеет порядковый номер 29 и располагается в четвертом периоде. Что примечательно, она находится в одной группе с благородными металлами. Это лишний раз подтверждает уникальность ее химических свойств, о которых следует рассказать более подробно.
Оттенки медных сплавов
В условиях невысокой влажности медь практически не проявляет химическую активность. Все меняется, если изделие поместить в условия, характеризующиеся высокой влажностью и повышенным содержанием углекислого газа.
В таких условиях начинается активное окисление меди: на ее поверхности формируется зеленоватая пленка, состоящая из CuCO3, Cu(OH)2 и различных сернистых соединений.
Такая пленка, которая называется патиной, выполняет важную функцию защиты металла от дальнейшего разрушения.
Окисление начинает активно происходить и тогда, когда изделие подвергается нагреву. Если металл нагреть до температуры 375 градусов, то на его поверхности формируется оксид меди, если выше (375-1100 градусов) — то двухслойная окалина.
Медь достаточно легко реагирует с элементами, которые входят в группу галогенов. Если металл поместить в пары серы, то он воспламенится. Высокую степень родства он проявляет и к селену. Медь не вступает в реакцию с азотом, углеродом и водородом даже в условиях высоких температур.
Внимание заслуживает взаимодействие оксида меди с различными веществами. Так, при его взаимодействии с серной кислотой образуется сульфат и чистая медь, с бромоводородной и иодоводородной кислотой — бромид и иодид меди.
Иначе выглядят реакции оксида меди с щелочами, в результате которых образуется купрат. Получение меди, при котором металл восстанавливается до свободного состояния, осуществляют при помощи оксида углерода, аммиака, метана и других материалов.
Медь при взаимодействии с раствором солей железа переходит в раствор, при этом железо восстанавливается. Такая реакция используется для того, чтобы снять напыленный медный слой с различных изделий.
Одно- и двухвалентная медь способна создавать комплексные соединения, отличающиеся высокой устойчивостью. Такими соединениями являются двойные соли меди и аммиачные смеси. И те и другие нашли широкое применение в различных отраслях промышленности.
Бухты медной проволоки
Области применения меди
Применение меди, как и наиболее схожего с ней по своим свойствам алюминия, хорошо известно — это производство кабельной продукции. Медные провода и кабели, характеризуются невысоким электрическим сопротивлением и особыми магнитными свойствами.
Для производства кабельной продукции применяются виды меди, характеризующиеся высокой чистотой.
Если в ее состав добавить даже незначительное количество посторонних металлических примесей, к примеру, всего 0,02% алюминия, то электрическая проводимость исходного металла уменьшится на 8–10%.
Невысокий вес меди и ее высокая прочность, а также способность поддаваться различным видам механической обработки — это те свойства, которые позволяют производить из нее трубы, успешно использующиеся для транспортировки газа, горячей и холодной воды, пара. Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран.
Медь, кроме исключительно высокой электропроводности, отличается способностью хорошо проводить тепло. Благодаря этому свойству она успешно используется в составе следующих систем:
- тепловые трубки;
- кулеры, использующиеся для охлаждения элементов персональных компьютеров;
- системы отопления и охлаждения воздуха;
- системы, обеспечивающие перераспределение тепла в различных устройствах (теплообменники).
Металлические конструкции, в которых использованы медные элементы, отличаются не только небольшим весом, но и исключительной декоративностью. Именно это послужило причиной их активного использования в архитектуре, а также для создания различных интерьерных элементов.
Шина электротехническая медная
Источник: http://met-all.org/cvetmet-splavy/med/fizicheskie-i-himicheskie-svojstva-medi.html
Рефераты, дипломные, курсовые работы — бесплатно: Библиофонд!
Контрольная работа
по дисциплине «химия и электроматериалы».
Вариант №1
Задание1. Основные физико-химические свойства меди, общие сведения о методе получения, основные области применения.
Преимущества меди, обеспечивающие ей широкое применение в качестве проводникового материала, следующие: 1) малое удельное сопротивление (из всех металлов только серебро имеет несколько меньшее удельное сопротивление, чем медь); 2) достаточно высокая механическая прочность; 3) удовлетворительная в большинстве случаев применения стойкость по отношению к коррозии (медь окисляется на воздухе даже в условиях высокой влажности значительно медленнее, чем, например, железо; интенсивное окисление меди происходит только при повышенных температурах);4)хорошая обрабатываемость: медь прокатывается в листы, ленты и протягивается в проволоку, толщина которой может быть доведена до тысячных долей миллиметра; 5) относительная легкость пайки и сварки.
В электровакуумном производстве применяют более чистую медь. Медь ре кристаллизируется при температуре 270° С. Влияние отжига на свойства меди таковы, что при отжиге значительнее изменяются механические свойства меди и слабее меняется ее удельное сопротивление.
Как проводниковый материал используют твердую и мягкую медь.
При холодной протяжке получают твердую медь (МТ), которая благодаря влиянию наклепа имеет высокий предел прочности при растяжении (360 — 390 МПа) и малое относительное удлинение перед разрывом, а также обладает твердостью и упругостью при изгибе; проволока из твердой меди не пружинит.
Если же медь подвергать отжигу, т.е. нагреву до нескольких сот градусов с последующим охлаждением, то получится мягкая медь (ММ), которая сравнительно пластична, имеет малую твердость и небольшую прочность (260 — 280 МПа), но весьма большое удлинение при разрыве и более высокую удельную проводимость.
Медь получают чаще всего путем переработки сульфидных руд. После ряда плавок руды и обжигов с интенсивным дутьем медь, предназначенная для электротехнических целей, обязательно проходит процесс электролитической очистки.
Полученные после электролиза катодные пластины меди переплавляют в болванки массой 80-90 кг, которые прокатывают и протягивают в изделия требующегося поперечного сечения.
При изготовлении проволоки, болванки сперва подвергают горячей прокатке в так называемую катанку диаметром 6,5-7,2 мм; затем катанку протравливают в слабом растворе серной кислоты, чтобы удалить с ее поверхности окись меди CuO, образовавшуюся при нагреве, и затем уже протягивают без подогрева в проволоку нужных диаметров — до 0,03-0,02 мм.
Твердую медь употребляют там, где надо обеспечить особо высокую механическую прочность, твердость и сопротивляемость истиранию; для контактных проводов, для шин распределительных устройств, для коллекторных пластин электрических машин и пр.
Мягкую медь в виде проволок круглого и прямоугольного сечения применяют главным образом в качестве токопроводящих жил кабелей и обмоточных проводов, где важна гибкость и пластичность (не должна пружинить при изгибе), а не прочность.
Задача № 1 (проводниковый материал).
Определить сопротивление проволочного резистора, выполненного из медного провода длиной 10 метров и сечением 0,05 мм2
Решение:
Сопротивление постоянному току медного провода прямо пропорционально длине провода и обратно пропорционального площади поперечного сечения:
Где R — сопротивление в Ом,
– удельное сопротивление меди (0,01754 мкОм×м),
l — длина проводника (10 м),
S — площадь поперечного сечения проводника (0,05 мм2).
Подставляя значения в формулу, получим:
Задание 2.Основные физико-химические свойства полистирола, общие сведения о методе получения, основные области применения.
Полистирол [СН(С6Н5)СН2]n — твердый прозрачный материал. Он является неполярным диэлектриком, с чем и связаны его высокие электроизоляционные свойства. Основными параметрами полистирола есть: r=1014-1015 Ом×м, нагревостойкость 70-80 °С, холодостойкость –60 °С, предел прочности при растяжении 35-60 МПа, плотность 1,05 Мг/м3.
Температура размягчения полистирола составляет +(70-85) °С. Относительная диэлектрическая проницаемость полистирола 2,4…2,6.
Недостатками его являются: хрупкость при пониженных температурах, склонность к постепенному образованию поверхностных трещин, малая стойкость к действию растворителей (в частности, жидких углеводородов) и невысокая нагревостойкость.
Задача № 2. (диэлектрический материал)
Рассчитать емкость плоского конденсатора и допустимое пробивное напряжение, где в качестве диэлектрика используется полистирол с геометрическими размерами 0,5х5х5 мм.
Решение:
Емкость плоского конденсатора рассчитывается по формуле:
– диэлектрическая постоянная (0,0885);
– относительная диэлектрическая постоянная полистирола (2,55);
S — площадь параллельных пластин (0,25 см2);
d — толщина диэлектрика (0,05 см).
Подставляя исходные данные в формулу, получим:
Допустимое пробивное напряжение рассчитывается по формуле:
Где Рреактдоп=0,5Вт — допустимая реактивная мощность;
f=10000Гц — частота переменного тока;
С- емкость конденсатора,Ф.
Подставляя исходные данные в формулу получим:
Задание 3.Основные физико-химические свойства железа и низкоуглеродистой стали, общие сведения о методе получения, основные области применения.
Низкоуглеродистая сталь – это сталь с содержанием углерода менее 0,1%, выплавляющаяся в электрических или мартеновских печах. Выпускается в виде листов толщиной 0,2-4 мм, марок Э, ЭА, ЭАА, ЭП355, ЭП620.
В наибольшей степени ухудшают магнитные свойства материала примеси углерода и серы. Их содержание не должно превышать сотых долей процента. Сталь поступает от предприятия — изготовителя в не отожженном состоянии с посредственными магнитными свойствами. Высокие магнитные свойства (проницаемость индукция насыщения и др.
) материал приобретает в результате специальной термообработки, которая заключается в медленном нагреве до 900 °С, длительной выдержке (2-4 часа) и медленном охлаждении (не более 40 °С в час) до 600 °С.
Для предохранения от окисления материал весь цикл термообработки находится либо в защитной среде, предохраняющей металл от окисления, либо в активной среде (азот + водород), обеспечивающей дополнительную очистку стали от примесей.
В результате термообработки, кроме очистки материала происходит увеличение размеров отдельных кристаллических зерен, сокращение числа зерен в единице объема и вследствие этого улучшение магнитных свойств материала.
Магнитные свойства сталей этих марок после термообработки характеризуются следующими параметрами:
Этот материал отличается низкой стоимостью, технологичностью, легко обрабатывается и штампуется, обладает в то же время сравнительно высокими магнитными свойствами в постоянных магнитных полях.
В переменных магнитных полях из-за низкого электрического сопротивления порядка 0,1 мкОм×м в этих сталях возникают большие потери на вихревые токи, особенно при больших значениях индукции. Это ограничивает применение листовых низкоуглеродистых сталей на низких частотах преимущественно областью слабых магнитных полей.
Из них изготавливают, например, сердечники трансформаторов, детали реле, элементы магнитных электрических и индукционных приборов.
Задача № 3. (магнитный материал)
Рассчитать индуктивность катушки с числом витков 50 и размерами сердечника диаметром 5 мм и высотой 10 мм, выполненного из железа или углеродистой стали.
Решение: Индуктивность катушки с заданными параметрами сердечника из заданного материала рассчитывается по формуле:
Где -магнитная постоянная (12,6),
– начальная магнитная проницаемость материала (600),
W — количество витков (50),
Sc– площадь сечения магнитного материала (см2),
lc– средняя длина магнитных силовых линий.
Для расчета площади сечения воспользуемся формулой
Где D — диаметр сердечника в сантиметрах.
lc » hсерд — высота сердечника (1 см)
Подставив данные в формулу, получим:
Задание 4. Зонная теория собственного полупроводника.
Полупроводники, в известном смысле, занимают промежуточное положение между традиционными проводниками и диэлектриками. С точки зрения зонной теории собственные полупроводники могут рассматриваться как диэлектрики с очень узкой запрещенной зоной.
Наиболее распространенными представителями собственных полупроводников являются кристаллы кремния и германия.
При сверх низких температурах такие кристаллы проявляют диэлектрические свойства, поскольку электроны оказываются неспособными преодолеть узкую запрещенную зону, отделяющую их от зоны проводимости.
Однако, даже комнатных температур оказывается достаточно для того, чтобы указанный энергетический барьер оказался преодолимым для электронов. В результате частицы, перешедшие в следующую разрешенную зону (зону проводимости) приобретают способность ускоряться электрическим полем и, следовательно, переносить ток.
При переходе электрона в зону проводимости из заполненной зоны (валентной зоны) в зону проводимости в первой остается незаполненное место, которое легко может занять какой-либо электрон из той же зоны. В результате образовавшаяся вакансия приобретает возможность перемещаться в пределах валентной зоны. Ее поведение во многом напоминает поведение частицы с положительным зарядом.
Для упрощения описания ансамбля из большого числа электронов в почти заполненной валентной зоне часто оказывается более удобным следить за имеющимися вакансиями, рассматривая их как некоторые гипотетические частицы — дырки (простым гидромеханическим аналогом дырки может служить пузырек в стакане с газированным напитком). Не являющиеся реальными объектами природы дырки, часто обладают весьма экзотическими свойствами. Так их эффективная масса не обязательно должна выражаться положительным числом, а зачастую оказывается тензорной величиной. Наряду с фотонами дырки представляют собой квазичастицы, вводимые в теорию на основе аналогий с формулами, описывающими поведение реальных объектов. Подобно положительным частицам дырки ускоряются электрическим полем и вносят свой вклад в проводимость полупроводниковых кристаллов.
Отметим, что электроны проводимости так же являются квазичастицами. С точки зрения квантовой механики все электроны кристалла являются принципиально неразличимыми, что делает бессмысленными попытки ответа на вопрос, какой именно электрон перешел в зону проводимости.
Электрический ток в кристалле обусловлен весьма сложным поведением всех без исключения имеющихся в нем электронов.
Однако описывающие это поведение уравнения обнаруживают близкое сходство с уравнениями движения лишь очень небольшого числа заряженных частиц — электронов и дырок.
Наряду с полупроводниками с собственной проводимостью существуют примесные полупроводники.
Последние получают внедрением в кристаллы собственных полупроводников (состоящих из атомов четырехвалентных элементов) примесей из трех или пяти валентных атомов (донорные и акцепторные примеси соответственно). Из-за малых концентраций атомов примесей их энергетически уровня в зоны не расщепляются.
В результате оказывающиеся на примесных уровнях электроны и дырки не обладают подвижностью.
С точки зрения энергетической схемы не участвующий в образовании валентных связей пятый электрон атома донорной примеси оказывается на уровне в непосредственной близости от зоны проводимости и легко переходит в эту зону. Образующаяся при этом дырка оказывается локализованной вблизи атома примеси. Т.
о. в примесных полупроводниках донорного типа преимущественно реализуется электроный характер проводимости. В полупроводниках с акцепторной примесью ситуация оказывается точно противоположной. Атом третьей группы захватывает недостающий для образования химической связи электрон у четырехвалентных соседей. В результате в валентной зоне возникают подвижные дырки, являющиеся носителями зарядов в таких системах.
Два p-n — перехода, разделенных узким полупроводниковым промежутком с примесной проводимостью образуют транзистор — простейшую полупроводниковую структуру, обладающую усилительными свойствами.
Список использованной литературы:
1. Н.П. Богородицкий, В.В. Пасынков, Б.М. Тареев. Электротехнические материалы, 1977г.;
2. Р.М.Терещук, К.М. Терещук, С.А. Седов. Полупроводниковые Приемно-усилительные устройства. Справочник радиолюбителя, 1989г.;
3. П. Эткинс. Молекулы, 1991г.;
4. Н.Н. Калинин и др. Электрорадиоматериалы, 1981г.
Источник: https://www.BiblioFond.ru/view.aspx?id=20748
Медь как металл и сырье в строительстве: ее особенности и нюансы обработки

В большей части промышленных отраслей используется такой металл, как медь. Благодаря высокой электропроводности без этого материала не обходится ни одна область электротехники.
Из нее образуются проводники, обладающими отличными эксплуатационными особенностями. Помимо этих особенностей медь обладает пластичностью и тугоплавкостью, устойчивостью к коррозии и агрессивным средам.
И сегодня мы рассмотрим металл со всех сторон: укажем цену за 1 кг лома меди, поведаем о ее использовании и производстве.
Медь представляет собой химический элемент, носящийся к первой группы периодической системы имени Менделеева. Этот пластичный металл имеет золотисто — розовый цвет и является одним из трех металлов с ярко выраженным окрашиванием. С давних времен активно используется человеком во многих областях промышленности.
Главной особенностью металла является его высокая электро- и теплопроводность. Если сравнивать с другими металлами, то проведение электрического тока через медь выше в 1,7 раз, чем у алюминия, и почти в 6 раз выше, чем у железа.
Медь имеет ряд отличительных особенностей перед остальными металлами:
- Пластичность. Медь представляет собой мягкий и пластичный металл. Если брать во внимание медную проволоку, она легко гнется, принимает любые положения и при этом не деформируется. Сам же металл достаточно немного надавить, чтобы проверить эту особенность.
- Устойчивость к коррозии. Этот фоточувствительный материал отличается высокой устойчивостью к возникновению коррозии. Если медь на длительный срок оставить во влажной среде, на ее поверхности начнет появляться зеленая пленка, которая и защищает металл от негативного влияния влаги.
- Реакция на повышение температуры. Отличить медь от других металлов можно путем ее нагревания. В процессе медь начнет терять свой цвет, а затем становиться темнее. В результате при нагреве металла он достигнет черного цвета.
Благодаря таким особенностям можно отличить данный материал от латуни, олова, бронзы и других металлов.
Видео ниже расскажет вам про полезные свойства меди:
Преимуществами данного металла являются:
- Высокий показатель теплопроводности;
- Устойчивость к влиянию коррозии;
- Достаточно высокая прочность;
- Высокая пластичность, которая сохраняется до температуры -269 градусов;
- Хорошая электропроводность;
- Возможность легирования с различными добавочными компонентами.
Про характеристики, физические и химические свойства вещества-металла меди и ее сплавов читайте ниже.
Свойства и характеристики
Медь, как малоактивный металл, не вступает во взаимодействие с водой, солями, щелочами, а также со слабой серной кислотой, но при этом подвержена растворению в концентрированной серной и азотной кислоте.
Физические свойства метала:
- Температура плавления меди составляет 1084°C;
- Температура кипения меди составляет 2560°C;
- Плотность 8890 кг/м³;
- Электрическая проводимость 58 МОм/м;
- Теплопроводность 390 м*К.
Механические свойства:
- Предел прочности на разрыв при деформированном состоянии составляет 350-450 МПа, при отожженном — 220-250 МПа;
- Относительное сужение в деформированном состоянии 40-60%, в отожженном — 70-80%;
- Относительное удлинение в деформированном состоянии составляет 5-6 δ ψ%, в отожженном — 45-50 δ ψ%;
- Твердость составляет в деформированном состоянии 90-110 НВ, в отожженном — 35-55 НВ.
При температуре ниже 0°С этот материал обладает более высокой прочностью и пластичностью, чем при +20°С.
Структура и состав
Медь, имеющая высокий коэффициент электропроводности, отличается наименьшим содержанием примесей. Доля их в составе может приравниваться 0,1%. С целью увеличения прочности меди в нее добавляют различные примеси: сурьма, цинк, олово, никель и прочее. В зависимости от ее состава и степени содержания чистой меди различают несколько ее марок.
Структурный тип меди может включать в себя также кристаллы серебра, никеля, кальция, алюминий, золота и других компонентов. Все они отличаются сравнительной мягкостью и пластичностью. Частичка самой меди имеет кубическую форму, атому которой расположены на вершинах F –ячейки. Каждая ячейка состоит из 4 атомов.
О том, где брать медь, смотрите в этом видеоролике:
В природных условиях данный металл содержится в самородной меди и сульфидных рудах. Широкое распространение при производстве меди получили руды под названием «медный блеск» и «медный колчедан», которые содержат до 2% необходимого компонента.
Большую часть (до 90%) первичного металла меди получают благодаря пирометаллургическому способу, который включает в себя массу этапов: процесс обогащения, обжиг, плавка, обработка в конвертере и рафинирование. Оставшаяся часть получается гидрометаллургическим способом, который заключается в ее выщелачивании разведенной серной кислоты.
Медь активно используется в следующих областях:
- Электротехническая промышленность, которая заключается, в первую очередь, в производстве электропроводов. Для этих целей медь должна быть максимально чистой, без посторонних примесей.
- Изготовление филигранных изделий. Медная проволока в отожженном состоянии отличается высокой пластичностью и прочностью. Именно поэтому, она активно используется при производстве различных шнуров, орнаментов и прочих конструкций.
- Переплавка катодной меди в проволоку. Самые разнообразные медные изделия переплавляются в слитки, которые идеально подходят для дальнейшей прокатки.
Медь активно используется в самых различных сферах промышленности. Она может входить в состав не только проволоки, но и оружия и даже бижутерии. Ее свойства и широкая сфера применения благоприятно повлияли на ее популярность.
Видео ниже расскажет о том, как медь может изменить свои свойства:
Источник: http://stroyres.net/metallicheskie/vidyi/tsvetnyie/med/kak-syire-v-stroitelstve.html
Популярная библиотека химических элементов
| 29 | |
|
Cu |
1 18 8 2 |
| МЕДЬ | |
| 63,546 | |
| 3d104s1 |
Элемент №29. Жизненно важный элемент. Главный металл электротехники. Один из самых важных, самых древних и самых популярных металлов. Популярных не только в среде инженеров — конструкторов, электриков и машиностроителей, но и у людей гуманитарных профессий — историков, скульпторов, литераторов.
Прочность
|
С помощью этой немудреной присказки хитрый Ходжа разделался с прохвостом-ростовщиком, а сам избежал расправы меднолобых стражников. Но допустим, что Ходжа Насреддин хорошо знал свойства меди и свою «дразнилку» адресовал не меднолобым стражникам, а оружейникам. Иначе говоря, стоит ли делать из меди щиты?
В любом техническом справочнике находим прочностные характеристики литой меди: предел прочности 17 кг/мм2 (при нормальной температуре), предел текучести* (при 500°C — жесткие, но вполне реальные условия работы многих изделий из меди) 2,2 кг/мм2.
Много это или мало? Предел текучести обычной стали в этих условиях достигает 100 кг/мм2. Противодействие ударным нагрузкам (а именно такие нагрузки в основном достаются щитам) у меди также меньше, чем у многих других металлов и сплавов.
Не отличается она и твердостью: медь, правда, тверже, чем золото и серебро, но в полтора раза мягче железа (соответственно 3,0 и 4,5 по 10-балльной шкале).
* Предел текучести — напряжение, при котором материал продолжает деформироваться без увеличения нагрузки.
У вас не создалось впечатления, что эти цифры, обрети они вдруг дар речи, повторили бы вслед за Ходжой Насреддином: «Тот, кто носит медный щит, тот имеет…»? Но не поддадимся «объективности» голых цифр. Ведь все они взяты из технической литературы XX столетия, а время медиых щитов, как и медных пушек, миновало много веков назад.
Оружейников древности и даже средневековья прочностные характеристики меди вполне устраивали.
Во-первых, нагрузка, которую испытывал щит при ударе копьем или секирой, куда меньше пробивной силы винтовочного выстрела.
Во-вторых, у древних металлургов не было другого материала, прочного, как медь, и доступного, как медь. Не случайно античный бог-кузнец Гефест выковал непобедимому Ахиллесу медный щит. Именно медный!
Как конструкционный материал медь широко используется и сейчас, но главную ценность приобрели уже не механические, а тепловые и электрические характеристики меди. По способности проводить тепло и электричество медь уступает только драгоценному серебру. У алюминия электросопротивление почти вдвое больше, чем у меди; а у железа — почти в шесть раз.
Но из меди делают не только проволоку и токопроводящие детали аппаратуры. Ее широко используют в химическом машиностроении при изготовлении вакуум-аппаратов, перегонных котлов, холодильников, змеевиков. Из меди и ее сплавов, как и прежде, делают орудия труда и инструмент.
В любом цехе, где работают с взрывоопасными или легковоспламеняющимися веществами, можно встретить молотки, стамески, отвертки из медных сплавов. Конечно, стальной инструмент прочнее, долговечнее, дешевле, но он «искрит».
Поэтому предпочитают чаще менять инструмент, больше тратить на его приобретение, но уменьшить пожаро- и взрывоопасность.
Гильзы патронов и артиллерийских снарядов обычно желтого цвета. Они сделаны из латуни — сплава меди с цинком. (В качестве легирующих добавок в латунь могут входить алюминий, железо, свинец, марганец и другие элементы).
Почему конструкторы предпочли латунь более дешевым черным сплавам и легкому алюминию? Латунь хорошо обрабатывается давлением и обладает высокой вязкостью.
Отсюда — хорошая сопротивляемость ударным нагрузкам, создаваемым пороховыми газами.
Большинство артиллерийских латунных гильз используется неоднократно. Не знаю, как сейчас, а в годы войны в любом артиллерийском дивизионе был человек (обычно офицер), ответственный за своевременный сбор стреляных гильз и отправку их на перезарядку.
В гильзовой латуни 68% меди.
Высокая стойкость против разъедающего действия соленой воды характерна для так называемых морских латуней. Это латуни с добавкой олова.
Знаменитый коррозионно-стойкий сплав томпак — это тоже латунь, но доля меди в нем больше, чем в любом другом сплаве этой группы — от 88 до 97%.
Еще одно важное свойство латуни: она, как правило, дешевле бронзы — другой важнейшей группы сплавов на основе меди.
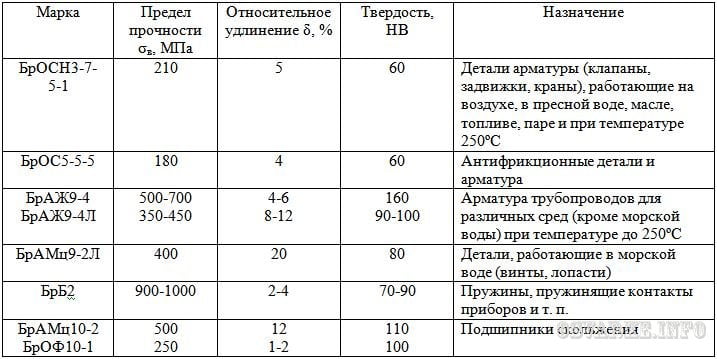
Первоначально бронзой называли только сплавы меди с оловом. Но олово — дорогой металл, и, кроме того, сочетание Сu — Sn не позволяет получить всех свойств, которые хотелось бы придать сплавам на основе меди. Сейчас существуют бронзы вообще без олова — алюминиевые, кремнистые, марганцовистые и т.д.
Бронзы
|
Но бронза — это не обязательно памятники. Без бронзовых вкладышей, втулок, сальников, клапанов не обходится ни один химический аппарат. Применение бронз во всех областях машиностроения из года в год расширяется. Из бронзы делают также инструмент, которым работают во взрывоопасных цехах.
Современные бронзы многообразны по составу и свойствам. Обычные оловянистые бронзы содержат до 33% Sn. В так называемую художественную бронзу, тысячелетиями применяемую для скульптурного литья, входит около 5% олова, до 10% цинка и около 3% свинца. В «автомобильных» и «подшипниковых» бронзах олова больше — 10…12%. Несколько слов о «безоловянных» бронзах.
Алюминиевые бронзы.
Источник: http://n-t.ru/ri/ps/pb029.htm