Большая Энциклопедия Нефти и Газа
Cтраница 1
Современная формулировка периодического закона следующая: свойства элементов, а также свойства и формы их соединений находятся в периодической зависимости от зарядов ядер атомов элементов. [1]
Современная формулировка периодического закона Д. И. Менделеева такова: свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда атомных ядер. Она только базируется на новых данных, которые придают закону и системе научную обоснованность и подтверждают их правильность. [2]
Современная формулировка периодического закона: свойства простых веществ и свойства соединений элементов находятся в периодической зависимости от заряда ядра ( атома) элемента. [3]
Современная формулировка периодического закона Д. И. Менделеева такова: свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда атомных ядер. Она только базируется на новых данных, которые придают закону и системе научную обоснованность и подтверждают их правильность. [4]
Современная формулировка периодического закона Д. И. Менделеева такова: свойства элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядер их атомов. [5]
Современная формулировка периодического закона Д. И. Менделеева такова: свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда атомных, ядер. Она только базируется на новых данных, которые придают закону и системе научную обоснованность и подтверждают их правильность. [6]
Чемсовременная формулировка периодического закона отличается от прежней и почему она является более точной. [7]
Входит всовременную формулировку Периодического закона Д. И. Менделеева: свойства элементов находятся в периодической зависимости от порядкового номера. [8]
Почему формулировка Д. И. Менделеева исовременная формулировка периодического закона не противоречат друг другу. [9]
| График закона Мозли. [10] |
На основании закона Мозли и открытий Резерфорда и Чэдвика можно датьсовременную формулировку периодического закона Д. И. Менделе-ева: свойства химических элементов и их соединений находятся в периодической зависимости от величины положительных зарядов ядер их атомов. [11]
Представление о величине заряда ядра как об определяющем свойстве атома легло в основусовременной формулировки периодического закона Д. И. Менделеева: свойства химических элементов, а также формы и свойства соединений этих элементов находятся в периодической зависимости от величины заряда ядер их атомов. [12]
Мы видим, что атомы одного и того же элемента различаются по величине атомных весов, и следовательно, химические свойства элементов определяются не их атомным весом, а зарядом ядра атома. Поэтомусовременная формулировка периодического закона гласит: свойства элементов находятся в периодической зависимости от их порядковых номеров. [13]
Исследования строения атомов показали, что важнейшей и наиболее устойчивой характеристикой атома является положительный заряд ядра. Поэтомусовременная формулировка периодического закона Д. И. Менделеева такова: свойства химических элементов и их соединений находятся в периодической зависимости от зарядов ядер атомов элементов. [14]
| Некоторые константы обыкновенной и тяжелой воды. [15] |
Страницы: 1 2
Источник: http://www.ngpedia.ru/id568136p1.html
Периодический закон Менделеева
 В 1871 году был сформулирован периодический закон Менделеева. К этому времени науке было известно 63 элемента, и Дмитрий Иванович Менделеев упорядочил их на основе относительной атомной массы. Современная периодическая таблица значительно расширилась.
В 1871 году был сформулирован периодический закон Менделеева. К этому времени науке было известно 63 элемента, и Дмитрий Иванович Менделеев упорядочил их на основе относительной атомной массы. Современная периодическая таблица значительно расширилась.
В 1869 году, работая над учебником химии, Дмитрий Менделеев столкнулся с проблемой систематизации материала, накопленного за много лет разными учёными — его предшественниками и современниками.
Ещё до работы Менделеева предпринимались попытки систематизировать элементы, что послужило предпосылками разработки периодической системы.
Рис. 1. Менделеев Д. И..
Поиски классификации элементов кратко описаны в таблице.
| Год | Учёный | Что сделано |
| 1829 | Иоганн Дёберейнер | Объединил элементы со схожими химическими свойствами в триады. Например, одну триаду составили Li, Na, K. Таблица включала пять триад |
| 1862 | Александр Шанкуртуа | Создал «земную спираль», расположив 50 элементов по спирали |
| 1864 | Джон Ньюлендс | Расположил элементы в порядке возрастания атомных масс и выявил сходство между каждым восьмым элементом. Закономерность была названа законом октав |
| 1864 | Лотар Мейер | Распределил 28 элементов по шести столбцам в соответствии с их валентностью |
Менделеев упорядочил элементы по относительной атомной массе, расположив их в порядке возрастания. Всего получилось девятнадцать горизонтальных и шесть вертикальных рядов. Это была первая редакция периодической таблицы элементов. С этого начинается история открытия периодического закона.
Учёному понадобилось почти три года, чтобы создать новую, более совершенную таблицу. Шесть столбцов элементов превратились в горизонтальные периоды, каждый из которых начинался щелочным металлом, а заканчивался неметаллом (инертные газы ещё не были известны). Горизонтальные ряды образовали восемь вертикальных групп.
В отличие от своих коллег Менделеев использовал два критерия распределения элементов:
- атомную массу;
- химические свойства.
Оказалось, что между двумя этими критериями прослеживается закономерность. После определённого количества элементов с возрастающей атомной массой, свойства начинают повторяться.
Рис. 2. Таблица, составленная Менделеевым.
Изначально теория не выражалась математически и не могла полностью подтвердиться экспериментально. Физический смысл закона стал понятен только после создания модели атома. Смысл заключается в повторении структуры электронных оболочек при последовательном увеличении зарядов ядер, что отражается на химических и физических свойствах элементов.
Установив периодичность изменений свойств с увеличением атомной массы, Менделеев в 1871 году сформулировал периодический закон, ставший основополагающим в химической науке.
Дмитрий Иванович определил, что свойства простых веществ находятся в периодической зависимости от относительных атомных масс.
Наука XIX века не обладала современными знаниями об элементах, поэтому современная формулировка закона несколько отличается от менделеевской. Однако суть остаётся прежней.
С дальнейшим развитием науки было изучено строение атома, что повлияло на формулировку периодического закона. Согласно современному периодическому закону свойства химических элементов зависят от зарядов атомных ядер.
Со времён Менделеева созданная им таблица значительно преобразилась и стала отражать практически все функции и характеристики элементов. Умение пользоваться таблицей необходимо для дальнейшего изучения химии. Современная таблица представлена в трёх формах:
- короткая – периоды занимают по две строчки, а водород часто относят к 7 группе;
- длинная – изотопы и радиоактивные элементы вынесены за пределы таблицы;
- сверхдлинная – каждый период занимает отдельную строку.
Рис. 3. Длинная современная таблица.
Короткая таблица — наиболее устаревший вариант, который был отменён в 1989 году, но по-прежнему используется во многих учебниках. Длинная и сверхдлинная формы признаны международным сообществом и используются по всему миру. Несмотря на установленные формы, учёные продолжают совершенствовать периодическую систему, предлагая новейшие варианты.
Периодический закон и периодическая система Менделеева были сформулированы в 1871 года. Менделеев выявил закономерности свойств элементов и упорядочил их на основе относительной атомной массы. С возрастанием массы менялись, а затем повторялись свойства элементов. Впоследствии таблица была дополнена, а закон скорректирован в соответствии с современными знаниями.
Источник: https://obrazovaka.ru/himiya/periodicheskiy-zakon-mendeleeva-sistema.html
Периодический закон — HIMI4KA
 ЕГЭ 2018 по химии › Подготовка к ЕГЭ 2018
ЕГЭ 2018 по химии › Подготовка к ЕГЭ 2018
Существуют две формулировки Периодического закона химических элементов: классическая и современная.
Классическая формулировка (в изложении его первооткрывателя Д.И. Менделеева): свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная формулировка: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
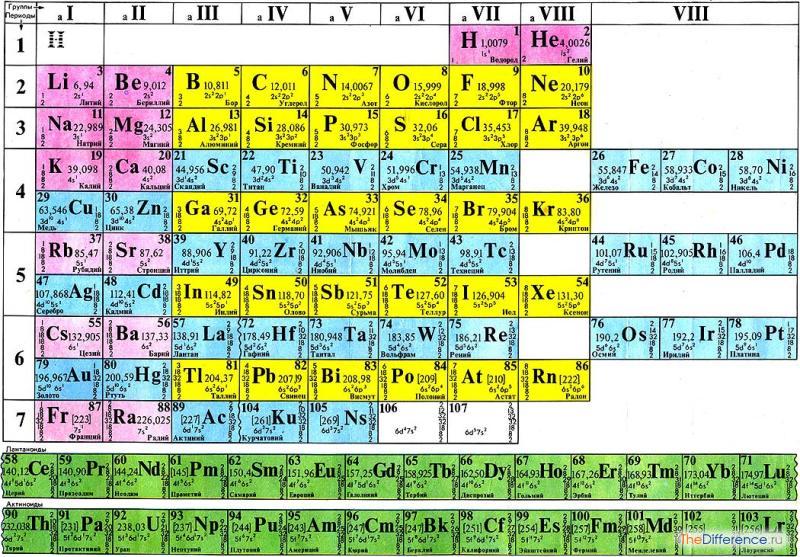
Графическим изображением Периодического закона является Периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространенными изображениями Периодической системы элементов Д. И. Менделеева являются короткая и длинная формы.
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгруппы.
Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов.
Химические свойства элементов главных и побочных подгрупп значительно различаются.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений.
В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы.
Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные оснОвные свойства, причем их основность возрастает с увеличением порядкового номера. Оксиды состава RO (за исключением BeO) проявляют основные свойства.
Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причем их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвертом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 29 элемента. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
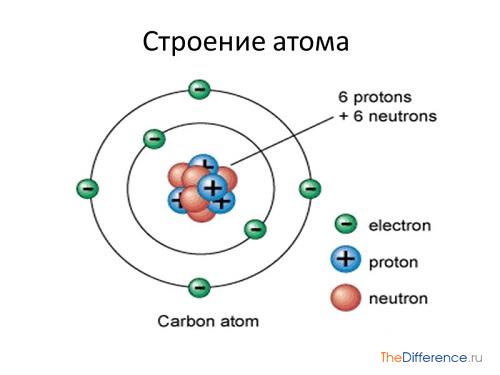
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус уменьшается.
Источник: https://himi4ka.ru/egje-2018-po-himii/1-2-periodicheskij-zakon.html
Периодический закон Д. И. Менделеева — урок. Химия, 8–9 класс

Периодический закон сформулирован Д. И. Менделеевым в (1869) году. К этому времени было известно (63) химических элемента. В качестве основного свойства элементов Менделеев выбрал относительную атомную массу. Учитывал также состав, физические и химические свойства образованных элементом простых и сложных веществ.
Расположив все известные химические элементы в порядке возрастания атомных масс, Менделеев обнаружил, что свойства повторяются через определённое число элементов.
Повторим действия Менделеева с учётом того факта, что благородные газы в его время ещё не были известны. Расположим элементы по возрастанию атомной массы (вторая строчка таблицы), укажем металлические и неметаллические свойства, формулы и свойства высших оксидов и гидроксидов, а также формулы газообразных водородных соединений.
Если внимательно проанализировать полученные последовательности, то можно увидеть повторяемость металлических и неметаллических свойств, состава и свойств соединений.
Через семь элементов от щелочного металла лития в ряду располагается щелочной металл натрий, а через семь элементов от галогена фтора — галоген хлор.
Через семь элементов появляются одинаковые формулы оксидов и водородных соединений, так как повторяются значения валентностей в соединениях с кислородом и водородом. Можем составить их общие формулы.
Формулы высших оксидов: .
Летучие водородные соединения (для неметаллов):.
Таким образом Менделеев установил периодичность изменения свойств с возрастанием атомной массы. В статье «Периодическая закономерность химических элементов» Д. И. Менделеев дал следующую формулировку периодического закона:
«Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от атомного веса».
В переводе на современный научный язык это звучит так:
«Свойства простых веществ, а также состав и свойства соединений элементов находятся в периодической зависимости от относительных атомных масс».
Все элементы Менделеев разделил на периоды.
Период — ряд элементов, расположенных в порядке возрастания относительной атомной массы, начинающийся щелочным металлом и заканчивающийся галогеном и инертным газом.
В периоде:
- постепенно ослабляются металлические свойства простых веществ и усиливаются неметаллические;
- высшая валентность элементов по кислороду возрастает от (у щелочных металлов) до (у галогенов);
- валентность элементов неметаллов в летучих водородных соединениях уменьшается от до (у галогенов);
- свойства высших оксидов и гидроксидов постепенно изменяются от основных через амфотерные до кислотных.
Периодический закон получил дальнейшее развитие после изучения физиками строения атома. Оказалось, что главной характеристикой химического элемента является не относительная атомная масса, а заряд ядра атома. Современная формулировка периодического закона несколько изменена:
«Свойства химических элементов и их соединений находятся в периодической зависимости от зарядов атомных ядер».
Источник: https://www.yaklass.ru/p/himija/89-klass/periodicheskii-zakon-i-stroenie-atomov-163960/periodicheskii-zakon-163961/re-b6214bb9-2a06-48c2-95e9-3b894f5941d1
Открытие периодического закона химических элементов Д.И. Менделеевым 31 декабря 1868

17 февраля (1 марта) 1869 г. Д.И. Менделеев сдал в набор рукопись «Опыт системы элементов, основанной на их атомном весе и химическом сходстве»– первый вариант Периодической таблицы элементов.
Окончательная формулировка Периодического закона — фундаментального закона природы была дана учёным в июле 1871 г.
Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не выражен в виде математического уравнения и его графическим (табличным) выражением является разработанная Менделеевым Периодическая система элементов.
ОТКРЫТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
Периодический закон был открыт Д. И. Менделеевым в ходе работы над текстом учебника «Основы химии», когда он столкнулся с трудностями систематизации фактического материала. К середине февраля 1869 г., обдумывая структуру учебника, учёный постепенно пришёл к выводу, что свойства простых веществ и атомные массы элементов связывает некая закономерность.
Открытие периодической таблицы элементов было совершено не случайно, это был результат огромного труда, длительной и кропотливой работы, которая была затрачена и самим Дмитрием Ивановичем, и множеством химиков из числа его предшественников и современников.
«Когда я стал окончательно оформлять мою классификацию элементов, я написал на отдельных карточках каждый элемент и его соединения, и затем, расположив их в порядке групп и рядов, получил первую наглядную таблицу периодического закона. Но это был лишь заключительный аккорд, итог всего предыдущего труда…» — говорил учёный.
Менделеев подчёркивал, что его открытие было итогом, завершившим собой двадцатилетнее размышление о связях между элементами, обдумывание со всех сторон взаимоотношений элементов.
17 февраля (1 марта) рукопись статьи, содержащая таблицу под названием «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», была закончена и сдана в печать с пометками для наборщиков и с датой «17 февраля 1869 г.».
Сообщение об открытии Менделеева было сделано редактором «Русского химического общества» профессором Н. А. Меншуткиным на заседании общества 22 февраля (6 марта) 1869 г.
Сам Менделеев на заседании не присутствовал, так как в это время по заданию Вольного экономического общества обследовал сыроварни Тверской и Новгородской губерний.
В первом варианте системы элементы были расставлены учёным по девятнадцати горизонтальным рядам и по шести вертикальным столбцам. 17 февраля (1 марта) открытие периодического закона отнюдь не завершилось, а только началось. Его разработку и углубление Дмитрий Иванович продолжал еще в течение почти трёх лет. В 1870 г.
Менделеев в «Основах химии» опубликовал второй вариант системы («Естественную систему элементов»): горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном.
Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться.
Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство.
Для того, чтобы периодичность полностью соблюдалась, Менделеев исправил атомные массы некоторых элементов, несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими, оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы.
В 1871 г. на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
Периодическая система элементов оказала большое влияние на последующее развитие химии.
Она не только была первой естественной классификацией химических элементов, показавшей, что они образуют стройную систему и находятся в тесной связи друг с другом, но и явилась могучим орудием для дальнейших исследований.
В то время, когда Менделеев на основе открытого им периодического закона составлял свою таблицу, многие элементы были еще неизвестны.
Менделеев был не только убеждён, что должны существовать неизвестные еще элементы, которые заполнят эти места, но и заранее предсказал свойства таких элементов, основываясь на их положении среди других элементов периодической системы. В течение следующих 15 лет предсказания Менделеева блестяще подтвердились; все три ожидаемых элемента были открыты (Ga, Sc, Ge), что было величайшим триумфом периодического закона.
Д.И. Менделеевым сдана в набор рукопись «Опыт системы элементов, основанной на их атомном весе и химическом сходстве» // Президентская библиотека // День в истории http://www.prlib.ru/History/Pages/Item.aspx?itemid=1006
РУССКОЕ ХИМИЧЕСКОЕ ОБЩЕСТВО
Русское химическое общество — научная организация, основанная при Санкт-Петербургском университете в 1868 г. и представлявшая собой добровольное объединение российских химиков.
О необходимости создания Общества было заявлено на 1-м Съезде русских естествоиспытателей и врачей, состоявшемся в Санкт-Петербурге в конце декабря 1867 — начале января 1868 г. На Съезде было оглашено решение участников Химической секции:
«Химическая секция заявила единодушное желание соединиться в Химическое общество для общения уже сложившихся сил русских химиков. Секция полагает, что это общество будет иметь членов во всех городах России, и что его издание будет включать труды всех русских химиков, печатаемые на русском языке».
К этому времени уже были учреждены химические общества в нескольких европейских странах: Лондонское химическое общество (1841), Химическое общество Франции (1857), Немецкое химическое общество (1867); Американское химическое общество было основано в 1876 г.
Устав Русского химического общества, составленный в основном Д. И. Менделеевым, был утверждён Министерством народного просвещения 26 октября 1868 г., а первое заседание Общества состоялось 6 ноября 1868 г. Первоначально в его состав вошли 35 химиков из Петербурга, Казани, Москвы, Варшавы, Киева, Харькова и Одессы. Первым Президентом РХО стал Н. Н.
Зинин, секретарём — Н. А. Меншуткин. Члены общества платили членские взносы (10 руб. в год), приём новых членов осуществлялся только по рекомендации трёх действующих. В первый год своего существования РХО выросло с 35 до 60 членов и продолжало плавно расти в последующие годы (129 — в 1879 г., 237 — в 1889 г., 293 — в 1899 г., 364 — в 1909 г.
, 565 — в 1917 г.).
В 1869 г. у РХО появился собственный печатный орган — «Журнал Русского химического общества» (ЖРХО); журнал выходил 9 раз в год (ежемесячно, кроме летних месяцев). Редактором ЖРХО с 1869 по 1900 был Н. А. Меншуткин, а с 1901 по 1930 — А. Е. Фаворский.
В 1878 г. РХО объединилось с Русским физическим обществом (основано в 1872 г.) в Русское физико-химическое общество. Первыми Президентами РФХО были А. М. Бутлеров (в 1878–1882 гг.) и Д. И. Менделеев (в 1883–1887 гг.).
В связи с объединением с 1879 г. (с 11-го тома) «Журнал Русского химического общества» был переименован в «Журнал Русского физико-химического общества».
Периодичность издания составляла 10 номеров в год; журнал состоял из двух частей — химической (ЖРХО) и физической (ЖРФО).
На страницах ЖРХО впервые были напечатаны многие труды классиков русской химии. Можно особо отметить работы Д. И. Менделеева по созданию и развитию периодической системы элементов и А. М. Бутлерова, связанные с разработкой его теории строения органических соединений; исследования Н. А. Меншуткина, Д. П. Коновалова, Н. С. Курнакова, Л. А. Чугаева в области неорганической и физической химии; В.
В. Марковникова, Е. Е. Вагнера, А. М. Зайцева, С. Н. Реформатского, А. Е. Фаворского, Н. Д. Зелинского, С. В. Лебедева и А. Е. Арбузова в области органической химии. За период с 1869 по 1930 г. в ЖРХО было опубликовано 5067 оригинальных химических исследований, печатались также рефераты и обзорные статьи по отдельным вопросам химии, переводы наиболее интересных работ из иностранных журналов.
РФХО стало учредителем Менделеевских съездов по общей и прикладной химии; три первых съезда прошли в С.-Петербурге в 1907, 1911 и 1922 гг. В 1919 г. издание ЖРФХО было приостановлено и возобновлено лишь в 1924 г.
Источник: https://histrf.ru/lenta-vremeni/event/view/otkrytiie-pieriodichieskogho-zakona-khimichieskikh-eliemientov-d-i-miendielieievym
Периодический закон и его современная формулировка
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА С ПОЗИЦИИ СОВРЕМЕННЫХ ПРЕДСТАВЛЕНИЙ ОБ АТОМАХ
Периодический закон и его современная формулировка
Изучая изменение химических свойств элементов в зависимости от величины их относительных атомных масс (атомного веса), Д. И.
Менделеев в[1] составляет периодическую систему элементов, а затем формулирует Периодический закон — один из основных законов природы: свойства элементов, а потому и свойства образуемых ими простых и сложных соединений находятся в периодической зависимости от их атомных масс.
Этот закон позволил провести не только строго научную классификацию элементов, уточнить значения атомных масс и валентностей некоторых из них, но он еще обладал огромной предсказательной способностью при открытии новых элементов.
Однако, наряду с бесспорными достоинствами периодического закона, имелись и существенные недостатки, которые ни Д. И. Менделеев, ни его последователи не могли объяснить, например, аномальное расположение элементов:и,и,и. Только впосле работ английского физика Мозли удалось понять эти аномалии. Исследуя рентгеновское излучение атомов, Мозли установил закон:
,
где- частота рентгеновского излучения,
– положительный заряд ядра или порядковый номер элемента,
и– постоянные,
который читается следующим образом: корень квадратный из частоты рентгеновского излучения пропорционален порядковому номеру элемента. Следовательно, основной характеристикой атома является ни его атомная масса (по Менделееву), а заряд ядра.
Поскольку химические свойства элементов обусловлены строением электронных оболочек атомов, то периодическая система Менделеева представляется естественной классификацией элементов по их электронным структурам.
Но при образовании химической связи электроны перераспределяются между атомами, а заряд ядра остаётся неизменным, поэтому современная формулировка периодического законагласит: свойства элементов, а также простых и сложных соединений находятся в периодической зависимости от зарядов ядер их атомов.
Указанные отступления от периодического закона объясняются существованием изотопов, так как большинство химических элементов в природе представляют собой естественную их смесь.
Изотопы — это разновидность атомов данного элемента, которые имеют один и тот же заряд ядра (содержат одинаковое число протонов в ядре), но различные массовые числа (содержат разное число нейтронов в ядре).
Поэтому относительная масса элемента с учётом его изотопного состава равна:
,
где– относительная атомная масса каждого сортаизотопов, составляющих данный элемент,– доля изотопав элементе. Например, рассчитаем относительные атомные массы элементов калияи аргона. Калий имеетизотопа с относительными атомными массами:
Тогда, используя формулу, получим:
Аргон имеет такжеизотопа с относительными атомными массами:
.
.
.
Поступая аналогично, будем иметь:
Поскольку заряд ядра атома аргона, а атома калия, то несмотря на большую относительную массу элемента, он находится в периодической таблице Д. И. Менделеева впереди атома калия.
Именно этим обстоятельством объясняются также нецелочисленные значения атомных масс химических элементов.
Формулировка периодического закона, которую дал Д. И. Менделеев, и современная формулировка в принципе не противоречат друг другу, потому что для большинства элементов при увеличении заряда ядер атомные массы также увеличиваются.
Дата добавления: 2016-06-05; просмотров: 1068;
Источник: https://poznayka.org/s9894t1.html
Рефераты, дипломные, курсовые работы — бесплатно: Библиофонд!

Физический смысл химической периодичности.”Свойства элементов, а потому и образуемых ими простых и сложных тел (веществ), стоят в периодической зависимости от их атомного веса”.
Современная формулировка:
“свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов”.
Физический смысл химической периодичности
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Период — горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов. Номер периода обозначает число энергетических уровней в атоме элемента.
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns2 np6).
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические — присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями.
Заполнение внешнего s- подуровня указывает на металлические свойства атома, а формирование внешнего p- подуровня — на неметаллические свойства. Увеличение числа электронов на p- подуровне (от 1 до 5) усиливает неметаллические свойства атома.
Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns2 np6) химически инертны.
В больших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n — 1) d- подуровня при сохранении внешнего ns2 — слоя. Большие периоды состоят из четных и нечетных рядов.
У элементов четных рядов на внешнем слое ns2 — электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np- подуровень, что объясняет значительное ослабление металлических свойств.
Группы — вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне).
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III — VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I — III групп (кроме бора) преобладают основные свойства, с IV по VIII — кислотные.
Источник: https://www.BiblioFond.ru/view.aspx?id=93411
Периодический закон Д.И.Менделеева и его трактовка с точки зрения современной теории строения атомов

На момент создания периодического закона :
1)было открыто не все химические элементы
2)для многих элементов значение атомных масс были определенны неправильно
3) некоторые химические елементы и их соединения были недостаточно выучены
Графическим изображением периодического закона является периодическая таблица химических елементов.В процессе написания таблицы. Д. И. Менделееву приходилось оставлять места ( незаполненные клетки ) для не открытых на тот момент элементов. Формулировка периодического закона, данная Д.И.
Менделеевым, гласила: свойства химических элементов находятся в периодической зависимости от атомных масс этих элементов. Современная формулировка гласит: свойства химических элементов находятся в периодической зависимости от заряда ядра этих элементов.
Такое уточнение потребовалось, поскольку к моменту установления Менделеевым периодического закона еще не было известно о строении атома.
После выяснения строения атома и установления закономерностей размещения электронов по электронным уровням стало ясно, что периодическая повторяемость свойств элементов связана с повторяемостью строения электронных оболочек.
69. Периодическая система элементов и ее структура .
Периодическая система химических элементов — естественная классификация химических элементов, являющаяся табличным выражением периодического закона Д.И. Менделеева. Прообразом Периодической системы химических элементов послужила таблица, составленная Д.И. Менделеевым 1 марта 1869 г.. В 1870 г. Менделеев назвал систему естественной, а в 1871 г. — периодической.
Число элементов в современной Периодической системе почти вдвое больше, чем было известно 60-х годах XIX в. (на сегодняшний день — 113), однако ее структура со времен Менделеева почти не изменилась.
Хотя за всю историю Периодической системы было опубликовано более 50 различных вариантов ее изображения, наиболее популярными являются предложенные Менделеевым короткопериодная и длиннопериодная формы.
Главный принцип построения Периодической системы — выделение в ней периодов (горизонтальных рядов) и групп (вертикальных столбцов) элементов. Современная Периодическая система состоит из 7 периодов (седьмой период должен закончиться 118-м элементом).
Короткопериодный вариант Периодической системы содержит 8 групп элементов, каждая из которых условно подразделяется на группу А (главную) и группу Б (побочную). В длиннопериодном варианте Периодической системы — 18 групп, имеющих те же обозначения, что и в короткопериодном.
Элементы одной группы имеют одинаковое строение внешних электронных оболочек атомов и проявляют определенное химическое сходство.
Номер группы в Периодической системе определяет число валентных электронов а атомах элементов.
При этом в группах, обозначенных буквой А, содержатся элементы, в которых идет заселениеs– и р-подуровней — s-элементы (IA- и IIA-группы) и р-элементы (IIIA-VIIIA-группы), а в группах, обозначенной буквой Б, находятся элементы, в которых заселяются d-подуровни — d-элементы.
Поскольку в каждом большом периоде должно находиться по 10 d-элементов (у которых заполняются пять d-орбиталей), то Периодическая система должна содержать 10 соответствующих групп.
Однако традиционно используется нумерация групп лишь до восьми, поэтому число групп d-элементов расширяется за счет введения дополнительных цифр — это IБ-VIIБ, VIIIБ0, VIIIБ1 и VIIIБ2-группы. Для f-элементов номеров групп не предусмотрено. Обычно их условно помещают в ячейки Периодической системы, отвечающие лантану (лантаноиды) и актинию (актиноиды). Символы лантаноидов и актиноидов выносятся за пределы Периодической системы в виде отдельных рядов.
Номер периода в Периодической системе соответствует числу энергетических уровней атома данного элемента, заполненных электронами.
Номер периода = Число энергетических уровней, заполненных электронами = Обозначение последнего энергетического уровня
Порядок формирования периодов связан с постепенным заселением энергетических подуровней электронами. Последовательность заселения определяется принципом минимума энергии, принципом Паули и правилом Гунда.
Периодическое изменение свойств элементов в периоде объясняется последовательностью заполнения электронами уровней и подуровней в атомах при увеличении порядкового номера элемента и заряда ядра атома.
70. Периодический характер изменения свойств элементов периодической системы .
В 1869 г. Менделеев открыл периодический закон изменения химических и физических свойств элементов в зависимости от их атомных масс.
Если расположить химические элементы в порядке возрастания их атомных масс, то периодически, через правильные промежутки, называемые периодами, элементы, оказавшиеся в таблице Менделеева в одном вертикальном ряду ( группе элементов), обнаруживают сходные физико-химические свойства. Однако сам Менделеев, расположив известные в его время 64 химических элемента в таблицу, отражающуюпериодическое изменение химических свойств элементов, был в ряде случаев вынужден отступить от принципа возрастания атомных масс. Менделеев ввел понятие о порядковом номере элемента, и, расположив химические элементы в порядке возрастания их номера, получил полную периодичность в изменении химических свойств элементов.
Рассмотрим элементы первого периода. Периоды — это горизонтальные последовательности химических элементов. И в атоме водорода (Н) и в атоме гелия (Не) все электроны находятся на первом электронном уровне. У атома водорода заряд ядра +1 и на первом электронном слое находится 1 электрон.
У атома гелия заряд ядра +2, и на первом электронном слое находится 2 отрицательно заряженных электрона. Попробуем понять в каком случае притяжение между ядром и электронами будет сильнее. Логично, что 2 больше, чем один. Значит электроны в атоме гелия притягиваются сильнее. Это означает, что они будут ближе находиться к ядру.
Следовательно размер гелия будет меньше ,будет меньше и его радиус.
Такая же закономерность будет повторяться в первом, втором и во всех последующих периодах. Это означает, что в периодах слева направо уменьшаются размеры атомов, а справа налево естественно увеличиваются.
Группа элементов это вертикальная последовательность химических элементов в периодической системе. Каждая из групп имеет две подгруппы: главную и побочную. Элементы первых трех периодов относятся только к главным подгруппам.
К главным подгруппам относятся также те элементы больших периодов (начиная с четвертого), которые расположены с той же стороны клеточки, как и элементы первых трех периодов.
Так например, химический элемент калий (К), расположенный в четвертом периоде первой группе относится к главной подгруппе, а медь (Cu), расположенная в том же периоде и той же группе — к побочной.
Рассмотрим два атома: атом водорода и атом лития (Li). Оба атома находятся в одной группе (I) и имеют по 1 электрону во внешнем электронном слое. Разница состоит в том, что у атома водорода внешний электрон находится на первом электронном слое, а у лития — на втором. Очевидно, что размер атома лития больше, чем атома водорода
Таким образом в группах сверху вниз размеры атомов увеличиваются.
С уменьшением размера атома увеличивается его способность притягивать не только свои электроны, но и принимать электроны от других атомов. Эта способность характеризует степень выраженности неметаллических свойств. Следовательно в периоде слева направо неметаллические свойства увеличиваются, а в группе сверху вниз уменьшаются.
Металлические свойства понимаемые химиками как способность отдавать электроны изменяются с точностью наоборот. В периоде неметаллические свойства слева-направо уменьшаются, а в группе напротив увеличиваются.
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
Источник: https://megalektsii.ru/s31088t9.html