Большая Энциклопедия Нефти и Газа

Cтраница 1
Отличие реального газа от идеального заключается в том, что в реальном газе в твй или иной мере проявляются силы молекулярного взаимодействия, и в том, что фактически молекулы его занимают хотя и очень малые, но, тем не менее, вполне конкретные конечные по величине объемы. Чем дальше отстоят молекулы газа друг от друга и чем меньше их линейные размеры по сравнению с расстояниями, отделяющими их друг от друга, тем меньше становятся силы взимодействия между ними и тем меньше реальный газ будет отличаться от идеального. [1]
Отличие реальных газов от идеального газа наглядно иллюстрируется изотермами в координатах Р-V. [2]
Коэффициенты / С, которые определяютотличие реальных газов от идеальных, приведены в приложении. Эти данные взяты главным образом из трудов Витте, и их можно считать за надежные и достаточно точные. В обычных расчетах можно обойтись без поправочного коэффициента Л, но при точных расчетах этот коэффициент необходимо использовать. [3]
Они проявляются во всех агрегатных состояниях вещества и обусловливают, в частности, отличие реальных газов от идеальных. [4]
Для получения уравнения состояния реального газа необходимо в уравнение состояния идеального газа внести поправки, учитывающие отличия реального газа от идеального. Силы межмолекулярного сцепления определяют поправку давления.
Межмолекулярные взаимодействия внутренних частиц взаимно уравновешены в каждый момент времени, и лишь молекулы, находящиеся у поверхности ( стенок) на расстоянии, меньшем радиуса действи сил сцепления, испытывают притяжение, направленное внутрь объема. [5]
Коэффициент z ( p T) в формуле (1.1.8) является поправкой к уравнению Клапейрона, отражающейотличие реального газа от идеального. Коэффициент определяется эмпирическим путем. Функция z строится в зависимости от относительных значений переменных р р р / рк, Тпр Т / ТК, гд. [6]
Характер изменения коэффициента сжимаемости z, который показывает отношение объема реального газа к объему идеального при одних и тех же услрвиях, с изменением температуры и давления можно установить, учитываяотличия реальных газов от идеальных.
В последних молекулы занимают незначительный объем ( по сравнению с объемом газа) и не испытывают сил притяжения друг к другу. Молекулы же реальных газов обладают определенными размерами, массой и взаимодействуют друг с другом.
Поэтому реальный газ приближается к идеальным при низких давлениях, когда число молекул в единице объема невелико. Следовательно, при низких давлениях величина коэффициента сжимаемости должна быть близка к единице.
С повышением давления молекулы газа сближаются и силы притяжения между молекулами начинают помогать внешним силам, сжимающим газ. Вследствие этого реальные газы должны сжиматься сильнее, чем при тех же условиях сжимаются идеальные газы.
Следовательно, с ростом давления коэффициент сжимаемости z должен вначале уменьшаться. Когда углеводородный газ сжат до такой степени, что он приближается по свойствам к жидкостям, межмолекулярные расстояния уменьшаются настолько, что начинают проявляться взаимоотталкивающие силы между молекулами, препятствующие дальнейшему уменьшению объема газа. [7]
Для значений температуры менее 10 000 К основная ошибка в расчетах обусловлена возможным несоответствием потенциала ф ( г) действительной энергии взаимодействия.
Пренебрежение поправками, возникающими из-заотличия реального газа от модели разреженного газа, приближенность учета эффекта внутренних степеней свободы на основе диффузионного механизма переноса энергии дает погрешность коэффициентов переноса, не превышающую нескольких процентов.
Также невелика погрешность, возникающая вследствие использования для возбужденных молекул и атомов тех же потенциалов взаимодействия, что и для молекул и атомов в основном состоянии. [8]
Лишь при низких давлениях ( Р 3 10е Па) значения PVm близки к теоретическому и реальные газы практически подчиняются законам идеального газа. По мере повышения давления наблюдается всеболее ощутимое отличие реальных газов от идеального газа. В приведенных примерах особенно ярко это выражено для углекислого газа. [10]
При изучении свойств различных веществ наряду с внутримолекулярными взаимодействиями, обусловленными действием валентных ( химических) сил и характеризующимися насыщаемостью, большими энергетическими эффектами и специфичностью, следует учитывать и взаимодействие между молекулами вещества.
В процессах расширения газов, конденсации, адсорбции, растворения и многих других проявляется действие именно этих сил. Часто их называют силами Ван-дер — Ваальса. Этим подчеркивается, что их существованием объясняетсяотличие реальных газов от идеальных, отличие величины Явн в уравнении (IV.
4) от нуля. [11]
При изучении свойств различных веществ наряду с внутримолекулярными взаимодействиями, обусловленными действием валентных ( химических) сил и характеризующимися насыщаемостью, большими энергетическими эффектами и специфичностью, следует учитывать и взаимодействие между молекулами вещества.
В процессах расширения газов, конденсации, адсорбции, растворения и многих других проявляется действие именно этих сил. Часто их называют силами Ван-дер — Ваальса. Этим подчеркивается, что их существованием объясняетсяотличие реальных газов от идеальных, отличие величины РВН в уравнении (IV.
4) от нуля. [12]
Рассмотрим, прежде всего, эффект Джоуля — Томсона в идеальном газе. Для идеального газа внутренняя энергия U является функцией одной только температуры. Произведение PV равно RT и тоже зависит только от температуры.
Поэтому и энтальпия идеального газа зависит от одной только температуры. При процессе Джоуля — Томсона энтальпия, а значит и температура идеального газа, не меняется.
Поэтому, как уже указывалось, изменение температуры и является чувствительным индикатором, указывающим наотличие реальных газов от идеального. [13]
Страницы: 1
Источник: http://www.ngpedia.ru/id230886p1.html
реальный газ — Чем реальный газ отличается от идеального газа ? — 22 ответа
В разделе Наука, Техника, Языки на вопрос Чем реальный газ отличается от идеального газа ? заданный автором Мила Менжинская лучший ответ это Идеа́льный газ — математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна) .
Ну, а реальный газ …В каждом конкретном случае это отдельная ииследовательская задача
Ответ от Пользователь удален[гуру]
Точно не помню…. Вроде… Теплообмен с окружающей средой все равно существует…
Ответ от Ачикулакская школа[активный]шериф и грег верно ответили, но не полностью.Идеальный газ — модель — абсолютно упругих шариков. (здесь только атомарные газы похоже на него, т. е.
инертные)Взаимодействие отсутствует м/у молекулами.Соударения абсолютно упругие. (соударение между молекулами не учитывается, т. к. взаимодействие любой отсутствует) .(в данном моменте реальные газы похожи лишь при больш8ой разряженности, при малой разряженности молекулы начинают взаимоденйствовать)Идеальный газ не учитывает структуру молекул.
При понижении температуры в определенный момент объем идеального газа становиться равным нулю, реальный же газ переходит в жидкость объем которой не может быть равным нулю.Идеальный газ не учитывает всех возможных степеней свободы молекул, так как он являет собой примитивные шарики.
Реальный газ похож на идеальный когда сильно разрежен и при обычных температурах.
Ответ от SheriFF[гуру]Идеальным принято считать газ, если: а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела; б) газ очень разряжен, т. е. расстояние между молекулами намного больше размеров самих молекул;
в) тепловое равновесие по всему объему достигается мгновенно. Условия, необходимые для того, чтобы реальный газ обрел свойства идеального, осуществляются при соответствующем разряжении реального газа. Некоторые газы даже при комнатной температуре и атмосферном давлении слабо отличаются от идеальных. Основными параметрами идеального газа являются давление, объем и температура.
Ответ от Дёминов Анатолий[гуру]
Поведением, не всегда ведет себя согласно теории
Ответ от Григорий Усатенко[мастер]
идеальный газ-это просто термин, обозначающий идеальные константы состояния этого газа (например, идеальное хаотичное движение частиц газа) термин введен для более точного расчера физических и хим. формул
Источник: http://22oa.ru/realnyi-gaz/
реальный газ — это… Что такое реальный газ?

- РЕАЛЬНЫЙ ГАЗ — газ, св ва к рого (в отличие от идеального газа) зависят от вз ствия молекул. В обычных условиях, когда ср. потенц. энергия межмолекулярного взаимодействия много меньше ср. кинетич. энергии молекул, св ва Р. г. и идеального различаются… … Физическая энциклопедия
- РЕАЛЬНЫЙ ГАЗ — отличается от идеального газа существованием взаимодействия между его частицами (молекулами, атомами). При малых плотностях наличие межмолекулярного взаимодействия учитывается вириальным уравнением состояния реального газа: pV = RTРЕАНИМАТОЛОГИЯ… … Большой Энциклопедический словарь
- реальный газ — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN real gasactual gas … Справочник технического переводчика
- Реальный газ — Изотермы реального газа (схематично) Синие изотермы при температуре ниже критической. Зелёные участки на них метастабильные состояния. Участок ле … Википедия
- реальный газ — realiosios dujos statusas T sritis Standartizacija ir metrologija apibrėžtis Dujos, kurių molekulės sąveikauja tarpusavyje. atitikmenys: angl. real gas vok. reelles Gas, n; wirkliches Gas, n rus. реальный газ, m pranc. gaz imparfait, m; gaz réel … Penkiakalbis aiškinamasis metrologijos terminų žodynas
- реальный газ — realiosios dujos statusas T sritis chemija apibrėžtis Dujos, kurių savybės neatitinka idealiųjų dujų savybių. atitikmenys: angl. real gas rus. реальный газ … Chemijos terminų aiškinamasis žodynas
- реальный газ — realiosios dujos statusas T sritis fizika atitikmenys: angl. actual gas; real gas vok. reelles Gas, n; wirkliches Gas, n rus. реальный газ, m pranc. gaz imparfait, m; gaz réel, m … Fizikos terminų žodynas
- реальный газ — realiosios dujos statusas T sritis Energetika apibrėžtis Dujos, kurių molekulės turi tūrį ir tarp jų veikia molekulinės jėgos. atitikmenys: angl. real gas vok. reales Gas, n rus. реальный газ, m pranc. gaz réel, m … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
- Реальный газ — газ, свойства которого существенно зависят от взаимодействия молекул (см. Межмолекулярное взаимодействие). В обычных условиях, когда средняя потенциальная энергия взаимодействия молекул много меньше их средней кинетической энергии,… … Большая советская энциклопедия
- РЕАЛЬНЫЙ ГАЗ — отличается от идеального газа существованием взаимодействия между его частицами (молекулами, атомами). При малых плотностях наличие межмолекулярного взаимодействия учитывается вириальным ур нием состояния Р. г.: pV=RT[1 + B(T)/V + C(Т)V2+ …],… … Естествознание. Энциклопедический словарь
Источник: https://dic.academic.ru/dic.nsf/es/48455/%D1%80%D0%B5%D0%B0%D0%BB%D1%8C%D0%BD%D1%8B%D0%B9
P-V-T СООТНОШЕНИЯ

Механическое состояние вещества в отличие от термодинамического можно описать при наличии известных величин давления, температуры и объема. Эти три параметра связаны между собой уравнением состояния, поэтому только два из них являются независимыми.
Уравнение состояния соответствующего вида может применяться для оценки многих важных свойств чистых веществ и их смесей.
Например, для прогнозирования плотности жидкой и паровой фаз, давления пара, критических свойств смесей, равновесия “жидкость-пар”, отклонений энтальпии и энтропии от идеального состояния.
В настоящее время не существует такого уравнения состояния, которое было бы применимо для оценки этих свойств любого органического вещества. На данный момент известно более 150 эмпирических уравнений состояния.
Они получены на основе обработки экспериментальных P-V-T-данных, сведений по эффекту Джоуля-Томпсона или данных о теплоемкости реальных газов при различных температурах и давлениях. По степени сложности вся совокупность уравнений состояний может быть разделена на некоторые группы.
В данном пособии рассматриваются в сопоставлении уравнения состояния каждой группы, широко применяемые при массовых расчетах. Приводятся также сведения, представляющие исторический интерес.
Начало исследований, посвященных изучению количественных соотношений между давлением, объемом и температурой, положено экспериментами Бойля (1662 г.), в результате которых он пришел к выводу, что при данной температуре объем газа обратно пропорционален его давлению.
Количественное выражение температурного воздействия было установлено Шарлем и Гей-Люссаком (1802 г.), которые обнаружили линейный характер этого отношения.
В 1801 г. Дальтон сформулировал закон парциальных давлений, согласно которому в смеси каждый газ ведет себя так, как если бы он один занимал весь объем. При этом общее давление смеси равно сумме парциальных давлений компонентов.
Парциальным давлением компонента называется то давление, которое оказывал бы газ, входящий в смесь, если бы из нее были удалены остальные газы при условии сохранения первоначальных объема и температуры.
В 1822 г. Каньяр де ля Тур открыл критическое состояние вещества.
В 1834 г. Клапейрон объединил законы Шарля и Бойля и впервые сформулировал закон идеальных газов.
Еще на первоначальном этапе исследований было обнаружено, что закон идеальных газов зачастую дает лишь приблизительное описание реального газа. Эти отклонения объяснялись тем, что молекулы имеют конечный объем и между ними существуют силы межмолекулярного взаимодействия.
В 1873 г. Ван-дер-Ваальс предложил уравнение, в котором количественно учтены оба этих фактора, определены условия сосуществования жидкой и паровой фаз и критическое состояние системы. Уравнение Ван-дер-Ваальса положено в основу многих современных уравнений состояния.
1880 г. — Амага сформулировал закон, который гласит, что объем смеси компонентов представляет собой сумму объемов этих компонентов, каждый из которых находится при температуре и давлении смеси.
1901 г. — Льюис ввел понятие фугитивности.
1927 г. — Урселл вывел, используя методы статистической механики, вириальное уравнение состояния.
В 50-х гг. XX столетия началось активное внедрение принципа соответственных состояний в практику прогнозирования многих свойств органических соединений. Развитие теории по вопросам описания свойств газов и жидкостей продолжается.
Идеальный газ
Понятие “идеальный газ” характеризует чисто гипотетическое состояние вещества. P-V-T соотношение для одного моля идеального газа описывается уравнением Менделеева-Клапейрона:
.(4.1)
Изотермы идеального газа в системе координат P-V представляют собой гиперболы, что иллюстрируется примером 4.1.
Пример 4.1
Для идеального газа показать зависимость P-V-T при температуре 500, 657 и 1170 К и объеме 100-3000 см3/ моль.
Решение
При 500 К и 100 см3/ моль имеем:= 82,06·500/100 = 410 атм.
При выражении давления в физических атмосферах, температуры в К, объема в см3/моль R = 82,06 (см3·атм)/(моль·К).
Фрагмент результатов расчета приведен в табл. 4.1 и на рис. 4.1.
Таблица 4.1
Давление идеального газа при T, К
Рис. 4.1. P-V соотношения идеального газа
Реальное состояние вещества
Степень отклонения свойств веществ, находящихся в реальном состоянии, от свойств идеального газа зависит от температуры и давления системы, а также от природы вещества. При высоких давлениях плотность паровой фазы может значительно превышать плотность жидкой фазы.
Так, при 1500 МПа и 338 К плотность газообразного водорода составляет 130 кг/м3, тогда как плотность жидкого водорода равна 70 кг/м3, а твердого — 80 кг/м3.
При плотности 1500 кг/м3 и температуре, превышающей критическую, фактический молярный объем азота в 16 раз больше молярного объема, рассчитанного по уравнению для идеальных газов.
Реальные газы отличаются от идеальных также характером изменения их теплофизических свойств. Теплоемкость идеального газа не зависит от давления, но на реальные газы это правило не распространяется. Вблизи критической точки многие свойства реальных газов изменяются аномально.
Силы, действующие между молекулами, а следовательно, и характер P-V-T функции, определяются тем, какими атомами представлена молекула, их взаимным расположением, а также размерами и формой самой молекулы. На молекулы действуют одновременно силы притяжения и отталкивания.
Действие сил притяжения проявляется сильнее с увеличением расстояния между ними, отталкивания — с его уменьшением.
Силы притяжения ведут к проявлению давления большей величины, чем давление, создаваемое кинетической энергией молекул, в то время как силы отталкивания уменьшают эффективный объем, доступный для молекулярного движения.
По электрическим свойствам молекулы можно подразделить:
· на электронейтральные, симметричные и, как правило, неполярные;
· асимметричные и, следовательно, обладающие дипольными, квадрупольными и пр. моментами, а значит, являющиеся полярными;
· обладающие остаточным зарядом, который может вызвать молекулярную ассоциацию и образование водородных связей.
Силы межмолекулярного взаимодействия проявляются между всеми молекулами, но наиболее сильными они оказываются при участии полярных молекул и, тем более, в случае молекул, склонных к ассоциации.
В настоящее время разработаны достаточно надежные подходы к прогнозированию свойств неполярных веществ. Для полярных веществ, особенно склонных к ассоциации, предложены приемы прогнозирования, обладающие меньшей универсальностью. Многие из них рассмотрены в данном пособии.
Изотермы реального газа в системе координат P-V существенно отличаются от гиперболы, особенно в области критической точки.
Критическое состояние вещества
Первые наблюдения над изменениями характеристик веществ, происходящими в критическом (жидкость-пар) состоянии, были проведены при нагревании жидкостей в запаянных стеклянных трубках. Метод экспериментального определения критических температур по исчезновению мениска в ампуле в настоящее время реализован А.Г. Назмутдиновым на кафедре ТО и НХС СамГТУ.
В общем случае критическое состояние может характеризовать не только равновесие “жидкость-пар”, а и состояние, например, двухфазной системы, в котором сосуществующие в равновесии несмешивающиеся жидкости становятся тождественными по всем своим свойствам. Для решения задач, рассматриваемых в данном пособии, важно парожидкостное равновесие.
Параметры системы, представленной индивидуальным веществом и находящейся в критическом состоянии (давление, температура, объем), называются критическими свойствами этого вещества. При температурах вышесосуществование рассматриваемых фаз в равновесии невозможно, система превращается в гомогенную. В этом смысле критическое состояние является предельным случаем двухфазного равновесия.
В критическом состоянии поверхностное (межфазное) натяжение на границе раздела сосуществующих фаз равно нулю, поэтому вблизи критического состояния легко образуются системы, состоящие из множества капель или пузырьков (эмульсии, аэрозоли, пены).
Вблизи критического состояния резко возрастает величина флуктуаций плотности (в случае чистых веществ) и концентраций компонентов (в многокомпонентных системах), что приводит к значительному изменению ряда физических свойств вещества. Наличие флуктуаций плотности приводит к оптической неоднородности системы, к рассеянию света.
Это явление носит название критической опалесценции. Рассеяние света служит источником сведений о величине и характере флуктуаций в критической области.
При приближении к критическому состоянию свойства сосуществующих фаз (плотность, теплоемкость и др.) изменяются резко, но без скачка. Поэтому критическое состояние наблюдается лишь при равновесии изотропных (isos — греч., равный; tropos- греч., свойство), т.е.
равных во всех направлениях фаз (жидких или газовых) или кристаллических фаз с одинаковым типом решетки. Независимо от природы сосуществующих фаз (типа двухфазного равновесия) и числа компонентов в критическом состоянии система имеет вариантность на 2 меньше, чем в обычном гомогенном состоянии, т.е.
число степеней свободы равно нулю.
Источник: http://MirZnanii.com/a/324584/p-v-t-sootnosheniya-realnyy-gaz-i-idealnyy-gaz
Чем отличаются реальный газ и идеальный поподробнее ,с физической точки зрения

29.06.2017
Чем отличаются реальный газ и идеальный поподробнее ,с физической точки зрения
- (Подробно)В обычных условиях, когда средняя потенциальная энергия взаимодействия молекул много меньше их средней кинетической энергии, свойства реальных газов незначительно отличаются от свойств идеального газа и к реальным газам применимы законы, установленные для идеального газа. Другими словами понятие( Реальный газ) ввели физики, для того, чтобы был так называемый эталон газа. И в нм были приняты следующие допущения:1)Размеры молекул малы по сравнению со средним расстоянием между ними; молекулы можно принимать за материальные точки.2)Силы притяжения между молекулыми не учитываются, а ситы отталкивания возникают только при соударениях молекул.3)Молекулы сталкиваются друг с другом как абсолютно упругие шары, движение которых описывается законами механики.Чтобы создать идеальный газ, нужно пренебречь межмолекулярным взаимодействием, но для реализации данного условия необходимо увеличивать температуру газа и расстояние между молкулами, тоесть разряжать газ. Например, водород, кислород, азот при н.у.(нормальных условиях) в атмосере можно рассматривать как идеальные газы.
- Слово идеальный означает воображаемый, реально не существующий.Реальный газ отличется от идеального наличием взаимодействия молекул. При малых плоностях в нем преобладают силы притяжения, что приводит к появлению дополнительного давления: газ как бы сжимает сам себя. При больших плотностях действуют силы отталкивания, вследтсвие чего молекула не допускает проникновения других молекул в занимаемый ею объем. Пренебрегать собственным объемом молекул реального газа нельзя.При не слишком высоком давлении (например, при атмосферном) и не слишком низкой температуре (например, при комнатной) реальный газ с достаточной степенью точности подчиняется законам идеального газа.Для объяснения свойств вещества в газообразном состоянии используется модель идеального газа. Идеальным принято считать газ, если:а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела;б) газ очень, разрежен, т. е. расстояние между молекулами намного больше размеров самих молекул;в) тепловое равновесие по всему объему достигается мгновенно.Условия, необходимые для того, чтобы реальный газ обрел свойства идеального, осуществляются при соответстсвующем разрежении реального газа. Некоторые газы даже при комнатной температуре и атмосферном давлении слабо отличаются от идеальных. Основными параметрами идеального газа являются давление, объем и температура.
Чем отличаются реальный газ и идеальный поподробнее ,с физической точки зрения Ссылка на основную публикацию
Источник: http://8.orange3.ru/19891/
Отличия идеального газа от реального
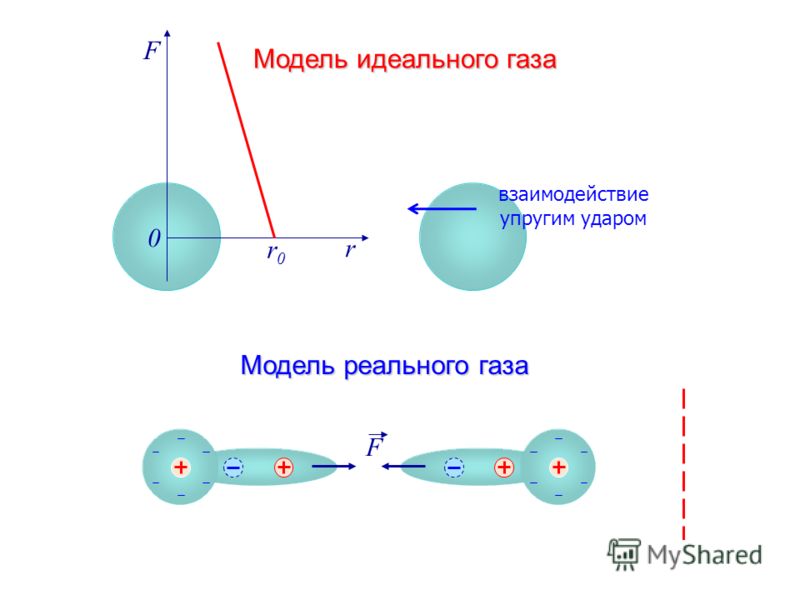
Главное отличие идеального газа от реального заключается в том, что в модели первого вещества практически не учитывается объем молекул, а также энергия их взаимодействия. В реальном газе соответствующие показатели учитываются. Вместе с тем при невысоком давлении и большой температуре реальный газ по своим свойствам близок к идеальному.
Сравнительная таблица
| Идеальный газ | Реальный газ |
| Что общего между ними? | |
| При определенных условиях реальный газ может быть приближен по свойствам к идеальному | |
| В чем разница между ними? | |
| Модель описания вещества не учитывает объем его молекул, а также энергию их взаимодействия друг с другом | Модель описания вещества учитывает объем его молекул и силу их взаимодействия |
Количество вещества
Так как размеры молекул очень малы, то чтобы избежать использования таких чисел в расчетах были введены такие величины, как:
Ar– относительная атомная масса вещества. (указана в таблице Менделеева)
Например здесь ArN=14.
Mr — относительная молекулярная масса. (она находится как сумма относительных атомных масс всех элементов входящих в молекулу)
Например:
молекула N2=>MrN2=2*14=28
Один моль — это количество вещества, в котором содержится столько же молекул и атомов, сколько атомов содержится в 0,012 кг углерода.
Число молекул, содержащихся в одном моле любого вещества — одинаково и называется числом Авогадро (NA).
NA=6,02*1023моль-1.
v=N/NA=m/M– количество вещества или количество молей вещества
N — число молекул вещества
m – масса вещества
М — молярная масса вещества (масса 1 моля вещества)
M=m0NA
т0 — масса молекулы
M=Mr*10-3кг/моль
Например: М(Н2О)=18.10-3кг/моль
Число молекул газа Nможно выразить:
N=mNA/M.
Массу одной молекулы m0можно определить по формуле:
m0=m/N=M/NA.
Закон Авогадро
Изучение свойств газов позволило итальянскому физику А. Авогадро в 1811г. высказать гипотезу, которая впоследствии была подтверждена опытными данными, и стала называться законом Авогадро: в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Из закона Авогадро вытекает важное следствие: моль любого газа при нормальных условиях (0С (273 К) и давлении 101,3 кПа) 10×занимает объем, равный 22,4 л. В этом объеме содержится 6,0223 молекул газа (число Авогадро).
Из закона Авогадро также следует, что массы равных объемов различных газов при одинаковых температуре и давлении относятся друг к другу как молярные массы этих газов:
где m1 и m2 — массы,
М1 и М2 — молекулярные массы первого и второго газов.
Поскольку масса вещества определяется по формуле
где ρ — плотность г аза,
V — объем газа,
то плотности различных газов при одинаковых условиях пропорциональны их молярным массам. На этом следствии из закона Авогадро основан простейший метод определения молярной массы веществ, находящихся в газообразном состоянии.
Закон Авогадро позволяет рассчитать плотность газа при нормальных условиях ) на основании отношения молярной массы М к объему моля:
.
Из этого уравнения можно определить молярную массу газа:
.
Источник: https://studlib.info/fizika/1043811-otlichiya-idealnogo-gaza-ot-realnogo/
Модель реального газа

Модель реального газа, предложенная Ван-дер-Ваальсом (1873), отличалась от модели идеального газа учетом объема самих молекул и их взаимодействия. Последний фактор несколько уменьшает давление — каждая молекула при столкновении как бы тормозится притяжением соседних. Так появилось новое уравнение состояния, которое получило имя автора.
При низких абсолютных температурах газы уже не похожи на газы, их свойства определяются квантовыми законами.
В этих условиях используют квантовые функции распределения, которые переходят в классические с повышением температуры.
Области, в которых наступают отклонения от закона распределения, называют областями вырождения газа (для водорода, например, эта область находится при Т = 1 К, для других газов — еще ниже).
Получение сжиженных газов, необходимых в промышленности, требовало разработки методов получения низких температур. Многое в этом направлении сделано академиком П. Л.
Капицей (1938), которому открытие сверхтекучести жидкого гелия принесло мировую славу. Через несколько лет Ландау построил теорию сверхтекучести жидкого гелия.
В предвоенные годы проблема сверхтекучести была одной из центральных проблем теоретической физики.
Установление понятия критической точки оказалось решающим в разработке методики и техники сжижения газов. В 1877 г. в Париже, в химической лаборатории Нормальной школы, Л.
Кальете провел опыт по сжижению кислорода: предварительно кислород был охлажден и сжат до 303,9 • 105 Па, затем резко расширен, в результате его температура упала до 90 К, и в этот момент в стеклянном приемнике возник туман — мельчайшие капельки жидкого кислорода. Вскоре Кальете тем же способом превратил в жидкость азот и водород. В Женеве в том же году Р.
П. Пикте получил уже несколько кубических сантиметров жидкого кислорода и водорода. В еще больших количествах их удалось получить польским физикам З. Врублевскому и К. Ольшевскому, когда они понизили температуру еще на 20 К путем испарения жидкого воздуха в пустоту (1885).
Используя эффект Джоуля—Томсона, отличающийся от охлаждения при адиабатическом расширении тем, что газ охлаждается без совершения работы, за счет сил взаимного притяжения, английский физико-химик Дж. Дьюар сумел получить уже несколько литров жидкого водорода (1893).
Стремление к беспорядку приводит к увеличению (в среднем) расстояния между частицами, часть кинетической энергии частиц переходит в потенциальную, и по мере уменьшения средней кинетической энергии уменьшается и температура газа.
Эффект Джоуля—Томсона используют для понижения температуры на порядок по сравнению с нормальной. При каждом процессе охлаждения температура падает незначительно, но система работает циклами, и в конце процесса сжиженный газ капает из сопла в колбу.
Дьюар изобрел сосуд для хранения сжиженных газов, который сейчас широко распространен (сосуд Дьюара).
Системы с последовательным сжатием и расширением газа широко используют для сжижения газа. Гелий превращается в жидкость при Т = 4,2 К. Впервые жидкий гелий получил нидерландский физик X. Камерлинг-Оннес в Лейдене путем охлаждения гелия ниже точки его инверсии с помощью жидкого водорода, кипящего под пониженным давлением (1908). Так он достиг температуры 1 К.
Из теоремы Нернста, называемой третьим началом термодинамики, следует, что при приближении температуры к нулю теплоемкости тоже стремятся к нулю, т. е. начинают зависеть от температуры (Т). По классической теории этого быть не должно. Значит, в рамках классической физики теорема Нернста не может быть объяснена.
Кроме того, из уравнения Клапейрона следует, что коэффициент теплового расширения и термический коэффициент давления не должны зависеть от температуры, а из теоремы Нернста получается, что они тоже обращаются в нуль при Т= 0.
Это значит, что при низких температурах перестает выполняться и уравнение Клапейрона—Менделеева.
Поскольку по третьему началу термодинамики при Т= 0 левые части обращаются в нуль, то в нуль должны обратиться и правые части, т.е. при Т= 0 давление газа не зависит от температуры, а определяется только плотностью, газ находится в состоянии вырождения. Пример такого газа — газ свободных электронов в металлах при обычных температурах.
К вырожденным газам не применима статистика Больцмана, поэтому разработана квантовая статистика Бозе—Эйнштейна (для бозонов). Из приведенных соотношений получается, что и внутренняя энергия перестает зависеть от температуры, определяясь только плотностью. Поэтому и газ свободных электронов в металлах не вносит заметного вклада в теплоемкость.
Источник: http://biofile.ru/bio/21402.html
ПОИСК
 Газы идеальный и реальный 10 Градиент температурный 150 [c.254]
Газы идеальный и реальный 10 Градиент температурный 150 [c.254]
Применительно к любому газу, идеальному и реальному. Однако то, что эта величина обладает свойствами параметра состояния, показано было лишь применительно к идеальному газу. Теперь, пользуясь свойствами обратимых циклов, можно показать, что и для гад [c.46]
Различают газы идеальные и реальные. К первым принадлежат такие, которые находятся далеко от жидкого состояния и трудно превращаются в жидкость. Например, атмосферный воздух и продукты сгорания топлива считаются идеальными газами.
Реальными газами называют такие, которые сравнительно легко превращаются в жидкость. Так, водяной пар, получаемый в паровых котлах, считают реальным газом.
Однако водяной пар, находящийся в продуктах сгорания топлива, относят к идеаль 1ым газам, так как он далек от жидкого состояния. [c.7]
Если имеются экспериментальные данные для реального газа для всей области рассмотренных условий, дифференциальные уравнения табл. 7 можно графически проинтегрировать. Однако когда нижним пре-делом интегрирования является очень низкое давление (в пределе р- 0), площадь под ри-изотермой становится неопределяемой. В этом случае более удобно определять остаточный объем а как разность между объемами идеального и реального газов при тех же температуре и давлении [c.159]
Чем отличаются теплоёмкости идеальных и реальных газов [c.85]
Следует подчеркнуть, что хотя уравнения (6.15)—(6.18) по форме совпадают с аналогичными уравнениями (5.44) (5.51), (5.52) и (5.
55) для смеси идеальных газов, между смесями идеальных и реальных газов имеется существенное различие.
Для идеальных газов имеет место аддитивность термодинамических свойств при смешении, тогда как для реальных газов подобная аддитивность отсутствует. [c.208]
ПОНЯТНЕ ОБ ИДЕАЛЬНОМ И РЕАЛЬНОМ ГАЗАХ [c.11]
Формула (9.6) справедлива для любых реальных и идеальных газов, сжимаемых в объемных и лопастных компрессорных машинах, а также для расчетов насосов, перекачивающих жидкости. Если принять газ идеальным и теплоемкость постоянной, то получим [c.121]
ИДЕАЛЬНЫЕ И РЕАЛЬНЫЕ ГАЗЫ [c.419]
Рассмотрим вопрос о существовании энтропии.
Положение о существовании энтропии может быть сформулировано в виде принципа адиабатической недостижимости в окрестности точки, изображающей равновесное состояние термически однородной системы, существуют точки, которые не могут быть достигнуты при движении вдоль обратимой адиабаты.
Поскольку через любую точку можно провести обратимую адиабату, то принцип недостижимости означает, что соседние адиабаты не пересекаются.
Этот факт является следствием опыта, который можно легко представить себе, взяв в качестве термодинамической системы, например, 1 кг газа (идеального или реального), помещенного в теплоизолированный цилиндр с поршнем. Естественно предположить, что каждая адиабата из рассматриваемого семейства кривых характеризуется определенным значением особого параметра и это значение одинаково для каждой точки выбранной адиабаты. Таким особым параметром и является энтропия. [c.89]
Наиболее отчетливо различие между идеальным и реальным газом проявляется при анализе зависимости так называемого коэффициента сжимаемости [c.96]
Не путать с коэффициентом сжимаемости Z (см. И), характеризующим различие между идеальным и реальным газами. [c.169]
РАБОЧЕЕ ТЕЛО ИДЕАЛЬНЫЙ И РЕАЛЬНЫЙ ГАЗЫ [c.16]
Это уравнение справедливо для потоков идеальных и реальных газов, паров и жидкостей. Для идеального газа h = с Ти поэтому для чего [c.51]
Как записываются уравнения состояния идеального и реального газов [c.43]
Объясните сущность внутренней энергии идеального и реального газов с молекулярной точки зрения. [c.43]
Как изменяется температура идеального и реальных газов при дросселировании [c.103]
Следует подчеркнуть, что хотя уравнения (6-14), (6-15), (6-16) и (6-17) по форме совпадают с аналогичными уравнениями (5-42) — (5-59) для смеси идеальных газов, между смесями идеальных и реальных газов имеется суш,ественное различие.
В случае идеальных газов имеет место аддитивность термодинамических свойств при смешении, выражаемая уравнениями (5-52) и (5-53), тогда как в случае реальных газов подобная аддитивность отсутствует и уравнений, аналогичных (5-52) и (5-53), не существует.
[c.211]
ИДЕАЛЬНЫЙ И РЕАЛЬНЫЙ ГАЗЫ. [c.5]
В главе V этой книги кратко излагается теорема о вириале, которая затем используется при выводе уравнения состояния для идеальных и реальных газов. [c.108]
| Рис. 15. Изотермы идеального и реального газа в диаграмме p — vp |
ПОНЯТИЕ ОБ ИДЕАЛЬНОМ И РЕАЛЬНОМ ГАЗАХ. ОСНОВНОЕ УРАВНЕНИЕ КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ [c.18]
Рабочее тела. Идеальный и реальный газ 15 [c.15]
Рабочее тело. Идеальный и реальный газ [c.15]
Смесь воздуха и пара является реальным газом. Как известно, свойства реальных газов тем больше отклоняются от свойств идеальных газов, чем выше плотность i-аза и чем ниже его температура. Отклонение особенно велико в области изменения агрегатного состояния пара.
При небольших давлениях и температурах, имеющих место в шахтах и большинстве других сооружений, сухой воздух по своим свойствам весьма приближается к идеальному газу. Водяной пар, находящийся в воздухе в состоянии, близком к насыщению, не может быть отнесен к идеальным газам.
Правда, водяной пар воздуха находится под весьма низким парциальным давлением. Таким образом, низкое давление пара приближает его свойства к свойствам идеального газа, а близость к состоянию насыщения — к свойствам реального газа.
Сравним термодинамические соотношения для влажного воздуха, рассматривая его как идеальный газ и как смесь идеального и реального газов. При расчетах влажного воздуха обычно наиболее важна зависимость между его влагосодержанием х или d.
относительной влажностью ф, давлением смеси В и давлением насыщенных паров при данной температуре P =f(t). При условии, что водяной пар — идеальный газ, такие соотношения, как известно, легко получить путем по- [c.6]
О—2, лежащей правее адиабаты. Точки /ад и 1 изображают состояние газа на выходе из соплового аппарата в идеальном и реальном процессах.
Сравнивая реальный и идеальный процессы расширения, протекающие до одного и того же давления, т. е.
до изобары р = 02, следует подчеркнуть, что в реальном процессе температура (теплосодержание) и соответственно удельный объем газа оказываются более высокими, чем в идеальном. [c.186]
Для того чтобы проинтегрировать последнее равенство, надо знать зависимость С/ от Г и /.
Несмотря на то, что мы рассматриваем стержни — термодинамический объект, совершенно отличный по своей природе от газов, как идеальных, так и реальных, имеется важное, хотя и формальное, сходство между уравнениями состояния в этих трех случаях — идеальные газы, реальные газы, идеальные стержни.
Это сходство заключается в том, что во всех трех случаях обобщенная сила (Р в случае газов,/в случае стержней) является линейной функцией температуры (уравнение (14.8)). Отсюда следует, что для идеального стержня С/ не зависит от /, подобно тому как для идеального и реального газов Су не зависит от V. [c.68]
Так как в линейном приближении Н М, то (дС м / дМ)т = О (так же как (дСу / дУ)т =0 для идеальных и реальных газов и (ЭС/ / д1)т =0 для идеальных стержней), и первое слагаемое в (15.16), а следовательно, и второе представляют собой полные дифференциалы. Для дифференциала функции и получаем на основании (15.6) [c.76]
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО И РЕАЛЬНОГО ГАЗОВ [c.103]
Следует подчеркнуть, что, несмотря на то, что уравнения (7-67) — (7-70) по форме полностью совпадают с аналогичными уравнениями (7-6) —(7-8), (7-16), (7-17) и (7-25) для смеси идеальных газов, между смесями идеальных и реальных газов имеется существенное различие. [c.154]
В книге изложены основные законы термодинамики. Рассмотрены уравнения состояния идеальных и реальных газов. Особое место уделено изложению метода исследования термодинамических процессов, термодинамики газового потока и циклам двигателей внутреннего сгорания. [c.2]
В баллоне емкостью 40 л заключен азот под давлением 75 бар и температурой 20° С. Пользуясь уравнениями идеального и реального газов, определить удельный объем азота и сравнить полученные результаты. [c.9]
Резервуар объемом 8 заполнен гелием. Определить количество газа, содержащееся в резервуаре с давлением 0,5 бар и температурой —180° С. Решить задачу по уравнениям состояния идеального и реального газов. [c.9]
Баллон емкостью 70 л наполнен кислородом со следующими параметрами р = 98 бар, / = 20° С. Используя уравнение состояния идеального и реального газов, определить массу газа. [c.9]
УСТАНОВИВШЕЕСЯ ДВИЖЕНИЕ ИДЕАЛЬНЫХ И РЕАЛЬНЫХ ГАЗОВ В ТРУЪАХ [c.114]
Идеальные и реальные газы. Превращение теплоты в механическую работу в тепловых установр ах происходит при участия рабочего тела, которым является газ или пар. Газы, которые встречаются на практике, называют реальными.
Молекулы эти я газов имеют конечный объем, между ними существуют силы пр ь тяжения, существенно влияющие на их параметры. Молекулы газа, заключенного в сосуд, находятся в непрерывном хаотическом движении. При этом они сталкиваются друг с другом н со стенками сосуда.
Таким образом, молекулы обладают кинетической энергией хаотического движения. А так как между молекулами существуют силы сцепления, то они обладают еще и определенной потенциальной энергией взаимодействия, которая зависит от расстояния между ними. Для простоты изучения свойст.
газообразного рабочего тела введено понятие — идеальный газ. [c.90]
Источник: http://mash-xxl.info/info/30069/